摘要:研究人員揭示了癌癥進(jìn)化背后的復(fù)雜過(guò)程,并定義了分析腫瘤基因組成的最佳算法。
在加州大學(xué)洛杉磯分校領(lǐng)導(dǎo)的一項(xiàng)新研究中,研究人員揭示了癌癥進(jìn)化背后的復(fù)雜過(guò)程,并定義了分析腫瘤基因組成的最佳算法。
研究結(jié)果發(fā)表在《自然生物技術(shù)》雜志上,詳細(xì)介紹了新的在線資源,這些資源可以幫助科學(xué)家選擇分析腫瘤演變的最佳算法,提高診斷準(zhǔn)確性和治療計(jì)劃。

圖1 戊型肝炎病毒復(fù)制的宿主和病毒衍生插入物的遺傳決定因素
了解腫瘤的進(jìn)化對(duì)治療癌癥至關(guān)重要。具有更多遺傳多樣性的腫瘤往往更難治療,更有可能抵抗治療。特定突變發(fā)生的時(shí)間也會(huì)影響治療的效果。
為了更好地測(cè)量進(jìn)化過(guò)程,科學(xué)家們使用亞克隆重建算法來(lái)分析來(lái)自腫瘤的DNA測(cè)序數(shù)據(jù),從而更好地了解癌癥如何開(kāi)始,生長(zhǎng)和對(duì)治療的反應(yīng),并為診斷和治療策略提供有價(jià)值的見(jiàn)解。
這種方法涉及復(fù)雜的數(shù)學(xué)和計(jì)算機(jī)算法,已成為更好地理解和跟蹤癌癥進(jìn)化過(guò)程的重要工具。然而,為了這項(xiàng)任務(wù),已經(jīng)開(kāi)發(fā)了幾十種算法,直到現(xiàn)在,還不清楚哪些是最準(zhǔn)確的,什么時(shí)候能很好地工作。這種不確定性已經(jīng)成為更廣泛臨床應(yīng)用的障礙。
加州大學(xué)洛杉磯分校大衛(wèi)·格芬醫(yī)學(xué)院人類遺傳學(xué)計(jì)算生物學(xué)家、該研究的第一作者之一Adriana Salcedo說(shuō):“不同算法的亞克隆重建結(jié)果差異很大。我們希望能夠更好地了解實(shí)驗(yàn)和算法選擇如何針對(duì)手頭的特定任務(wù)進(jìn)行優(yōu)化,這可以幫助正在開(kāi)發(fā)這些算法的科學(xué)家,以及將這些算法應(yīng)用于自己研究的人,這樣他們就可以為自己的目的選擇最好的算法,然后反過(guò)來(lái)可以以更明智的方式解釋結(jié)果。”
為了了解哪種算法對(duì)不同的任務(wù)最準(zhǔn)確,Salcedo和加州大學(xué)洛杉磯分校的其他研究人員組成了一個(gè)全球聯(lián)盟。該小組發(fā)起了一項(xiàng)為期7年的努力,名為ICGC-TCGA DREAM體細(xì)胞突變召喚-腫瘤異質(zhì)性和進(jìn)化挑戰(zhàn)。世界各地的研究小組使用云計(jì)算對(duì)腫瘤進(jìn)化的七個(gè)不同方面進(jìn)行基準(zhǔn)測(cè)試,總共進(jìn)行了12061次分析。
通過(guò)分析這些數(shù)據(jù),Salcedo發(fā)現(xiàn)只有少數(shù)腫瘤特征會(huì)顯著影響重建算法的準(zhǔn)確性。雖然測(cè)序數(shù)據(jù)質(zhì)量和腫瘤純度等實(shí)驗(yàn)因素也有一定影響,但在決定準(zhǔn)確性方面,算法的選擇比腫瘤本身的特征更重要。
他們還發(fā)現(xiàn),沒(méi)有一種算法在所有任務(wù)上都表現(xiàn)最好,組合多種算法的標(biāo)準(zhǔn)方法并沒(méi)有顯著提高準(zhǔn)確率。
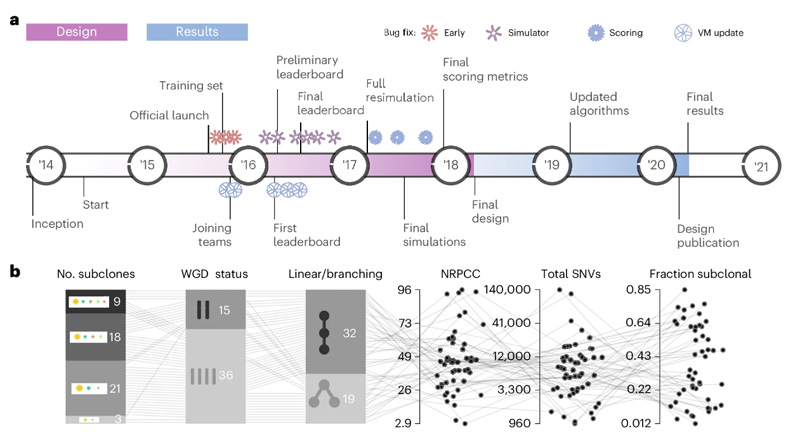
圖2 充滿挑戰(zhàn)的設(shè)計(jì)
加州大學(xué)洛杉磯分校大衛(wèi)·格芬醫(yī)學(xué)院泌尿?qū)W和人類遺傳學(xué)教授Paul Boutros說(shuō):“我們很驚訝,算法本身如此重要。這為研究人員如何轉(zhuǎn)化研究、臨床試驗(yàn)并最終完全預(yù)測(cè)癌癥進(jìn)化的復(fù)雜性提供了直接的實(shí)用見(jiàn)解。”
由于不同的算法最適合亞克隆重建的不同子任務(wù),該團(tuán)隊(duì)提供了在線工具,幫助用戶根據(jù)他們的數(shù)據(jù)集和感興趣的問(wèn)題選擇最合適的算法。
該團(tuán)隊(duì)目前正在努力找出現(xiàn)有技術(shù)可以改進(jìn)的地方,以更好地代表癌細(xì)胞的持續(xù)變化,并制作更好的癌癥進(jìn)化模擬器。還需要指導(dǎo)在哪些方面需要新的人工智能來(lái)提高測(cè)量癌癥進(jìn)化的能力。
Boutros說(shuō):“通過(guò)創(chuàng)新的計(jì)算方法揭示腫瘤動(dòng)力學(xué)的復(fù)雜性,我們可以預(yù)測(cè)癌癥的發(fā)展方向。通過(guò)了解它的去向,我們可以設(shè)計(jì)出阻止癌癥變得致命的治療方法。”
Boutros還擔(dān)任加州大學(xué)洛杉磯分校David Geffen醫(yī)學(xué)院的臨時(shí)研究副院長(zhǎng),加州大學(xué)洛杉磯分校精確健康研究所癌癥信息學(xué)副主任,并且是Eli和Edythe Broad再生醫(yī)學(xué)和干細(xì)胞研究中心的成員。該研究的另一位資深作者是MD安德森癌癥中心的Peter Van Loo。該研究的另一位共同第一作者是弗朗西斯·克里克研究所的馬克西姆·塔拉比奇。
參考資料
[1] Crowd-sourced benchmarking of single-sample tumor subclonal reconstruction
摘要:研究人員揭示了癌癥進(jìn)化背后的復(fù)雜過(guò)程,并定義了分析腫瘤基因組成的最佳算法。
在加州大學(xué)洛杉磯分校領(lǐng)導(dǎo)的一項(xiàng)新研究中,研究人員揭示了癌癥進(jìn)化背后的復(fù)雜過(guò)程,并定義了分析腫瘤基因組成的最佳算法。
研究結(jié)果發(fā)表在《自然生物技術(shù)》雜志上,詳細(xì)介紹了新的在線資源,這些資源可以幫助科學(xué)家選擇分析腫瘤演變的最佳算法,提高診斷準(zhǔn)確性和治療計(jì)劃。

圖1 戊型肝炎病毒復(fù)制的宿主和病毒衍生插入物的遺傳決定因素
了解腫瘤的進(jìn)化對(duì)治療癌癥至關(guān)重要。具有更多遺傳多樣性的腫瘤往往更難治療,更有可能抵抗治療。特定突變發(fā)生的時(shí)間也會(huì)影響治療的效果。
為了更好地測(cè)量進(jìn)化過(guò)程,科學(xué)家們使用亞克隆重建算法來(lái)分析來(lái)自腫瘤的DNA測(cè)序數(shù)據(jù),從而更好地了解癌癥如何開(kāi)始,生長(zhǎng)和對(duì)治療的反應(yīng),并為診斷和治療策略提供有價(jià)值的見(jiàn)解。
這種方法涉及復(fù)雜的數(shù)學(xué)和計(jì)算機(jī)算法,已成為更好地理解和跟蹤癌癥進(jìn)化過(guò)程的重要工具。然而,為了這項(xiàng)任務(wù),已經(jīng)開(kāi)發(fā)了幾十種算法,直到現(xiàn)在,還不清楚哪些是最準(zhǔn)確的,什么時(shí)候能很好地工作。這種不確定性已經(jīng)成為更廣泛臨床應(yīng)用的障礙。
加州大學(xué)洛杉磯分校大衛(wèi)·格芬醫(yī)學(xué)院人類遺傳學(xué)計(jì)算生物學(xué)家、該研究的第一作者之一Adriana Salcedo說(shuō):“不同算法的亞克隆重建結(jié)果差異很大。我們希望能夠更好地了解實(shí)驗(yàn)和算法選擇如何針對(duì)手頭的特定任務(wù)進(jìn)行優(yōu)化,這可以幫助正在開(kāi)發(fā)這些算法的科學(xué)家,以及將這些算法應(yīng)用于自己研究的人,這樣他們就可以為自己的目的選擇最好的算法,然后反過(guò)來(lái)可以以更明智的方式解釋結(jié)果。”
為了了解哪種算法對(duì)不同的任務(wù)最準(zhǔn)確,Salcedo和加州大學(xué)洛杉磯分校的其他研究人員組成了一個(gè)全球聯(lián)盟。該小組發(fā)起了一項(xiàng)為期7年的努力,名為ICGC-TCGA DREAM體細(xì)胞突變召喚-腫瘤異質(zhì)性和進(jìn)化挑戰(zhàn)。世界各地的研究小組使用云計(jì)算對(duì)腫瘤進(jìn)化的七個(gè)不同方面進(jìn)行基準(zhǔn)測(cè)試,總共進(jìn)行了12061次分析。
通過(guò)分析這些數(shù)據(jù),Salcedo發(fā)現(xiàn)只有少數(shù)腫瘤特征會(huì)顯著影響重建算法的準(zhǔn)確性。雖然測(cè)序數(shù)據(jù)質(zhì)量和腫瘤純度等實(shí)驗(yàn)因素也有一定影響,但在決定準(zhǔn)確性方面,算法的選擇比腫瘤本身的特征更重要。
他們還發(fā)現(xiàn),沒(méi)有一種算法在所有任務(wù)上都表現(xiàn)最好,組合多種算法的標(biāo)準(zhǔn)方法并沒(méi)有顯著提高準(zhǔn)確率。

圖2 充滿挑戰(zhàn)的設(shè)計(jì)
加州大學(xué)洛杉磯分校大衛(wèi)·格芬醫(yī)學(xué)院泌尿?qū)W和人類遺傳學(xué)教授Paul Boutros說(shuō):“我們很驚訝,算法本身如此重要。這為研究人員如何轉(zhuǎn)化研究、臨床試驗(yàn)并最終完全預(yù)測(cè)癌癥進(jìn)化的復(fù)雜性提供了直接的實(shí)用見(jiàn)解。”
由于不同的算法最適合亞克隆重建的不同子任務(wù),該團(tuán)隊(duì)提供了在線工具,幫助用戶根據(jù)他們的數(shù)據(jù)集和感興趣的問(wèn)題選擇最合適的算法。
該團(tuán)隊(duì)目前正在努力找出現(xiàn)有技術(shù)可以改進(jìn)的地方,以更好地代表癌細(xì)胞的持續(xù)變化,并制作更好的癌癥進(jìn)化模擬器。還需要指導(dǎo)在哪些方面需要新的人工智能來(lái)提高測(cè)量癌癥進(jìn)化的能力。
Boutros說(shuō):“通過(guò)創(chuàng)新的計(jì)算方法揭示腫瘤動(dòng)力學(xué)的復(fù)雜性,我們可以預(yù)測(cè)癌癥的發(fā)展方向。通過(guò)了解它的去向,我們可以設(shè)計(jì)出阻止癌癥變得致命的治療方法。”
Boutros還擔(dān)任加州大學(xué)洛杉磯分校David Geffen醫(yī)學(xué)院的臨時(shí)研究副院長(zhǎng),加州大學(xué)洛杉磯分校精確健康研究所癌癥信息學(xué)副主任,并且是Eli和Edythe Broad再生醫(yī)學(xué)和干細(xì)胞研究中心的成員。該研究的另一位資深作者是MD安德森癌癥中心的Peter Van Loo。該研究的另一位共同第一作者是弗朗西斯·克里克研究所的馬克西姆·塔拉比奇。
參考資料
[1] Crowd-sourced benchmarking of single-sample tumor subclonal reconstruction



