摘要:研究人員已經(jīng)確定了導(dǎo)致阿爾茨海默病患者線粒體功能障礙的機(jī)制。
美因茨約翰內(nèi)斯·古騰堡大學(xué)(JGU)的一組研究人員已經(jīng)確定了導(dǎo)致阿爾茨海默病患者線粒體功能障礙的機(jī)制,從而導(dǎo)致大腦能量供應(yīng)減少。JGU制藥和生物醫(yī)學(xué)科學(xué)研究所的克里斯蒂娜·弗里德蘭教授說(shuō):“這種效應(yīng)可歸因于一種以前未被報(bào)道過(guò)的RNA修飾。”她與同事Mark Helm教授合作指導(dǎo)了相關(guān)研究。他們的研究結(jié)果有助于更好地理解阿爾茨海默病的病理生理學(xué)。美因茨大學(xué)醫(yī)學(xué)中心、分子生物學(xué)研究所、洛林大學(xué)和維也納醫(yī)科大學(xué)的研究小組也參與了這項(xiàng)研究。相應(yīng)的論文發(fā)表在《分子精神病學(xué)》上。

圖1 ND5 mRNA中腺苷(m1A)的N1甲基化導(dǎo)致阿爾茨海默病的復(fù)合物I功能障礙
受功能紊亂影響的“細(xì)胞發(fā)電站”
線粒體通常被稱為細(xì)胞的動(dòng)力源,是細(xì)胞內(nèi)的細(xì)胞器,負(fù)責(zé)向全身尤其是大腦提供能量。大腦95%的能量依賴于線粒體中的葡萄糖代謝。人們?cè)缇椭溃咸烟谴x障礙發(fā)生在阿爾茨海默病的早期階段。這種損傷是由于衰老過(guò)程和β淀粉樣蛋白的積累引起的線粒體功能失調(diào)。
三磷酸腺苷(ATP)形式的能量來(lái)源通過(guò)呼吸鏈的一系列反應(yīng)在線粒體內(nèi)膜形成。參與這一過(guò)程的有一千多種蛋白質(zhì),它們從細(xì)胞核運(yùn)輸?shù)骄€粒體。“但也有一些蛋白質(zhì)是由線粒體自己合成的。其中之一是ND5,它是呼吸鏈復(fù)合體I的一個(gè)亞基,”克里斯蒂娜·弗里德蘭教授解釋說(shuō)。一種叫做NADH的物質(zhì)給復(fù)合體I提供電子,復(fù)合體I將電子轉(zhuǎn)移給泛醌,產(chǎn)生泛醇。在這個(gè)過(guò)程中,四種蛋白質(zhì)從基質(zhì)中被泵入膜間空間。ND5在這一聯(lián)系中起著重要作用,該亞基的線粒體編碼基因的任何突變都可能導(dǎo)致嚴(yán)重的線粒體疾病,如Leigh綜合征。
已經(jīng)證明,為這種蛋白質(zhì)的合成提供指令的mRNA可以經(jīng)歷甲基化。在體細(xì)胞中,mRNA攜帶遺傳信息,并與tRNA一起負(fù)責(zé)將遺傳信息翻譯成蛋白質(zhì)。mRNA的甲基化導(dǎo)致其化學(xué)結(jié)構(gòu)的改變,使其不能再正確地與tRNA相互作用。弗里德蘭補(bǔ)充說(shuō):“合成過(guò)程被破壞,形成的ND5亞基蛋白質(zhì)更少,而ND5是復(fù)合物I的核心相關(guān)蛋白,因?yàn)檎麄€(gè)過(guò)程始于呼吸鏈。”
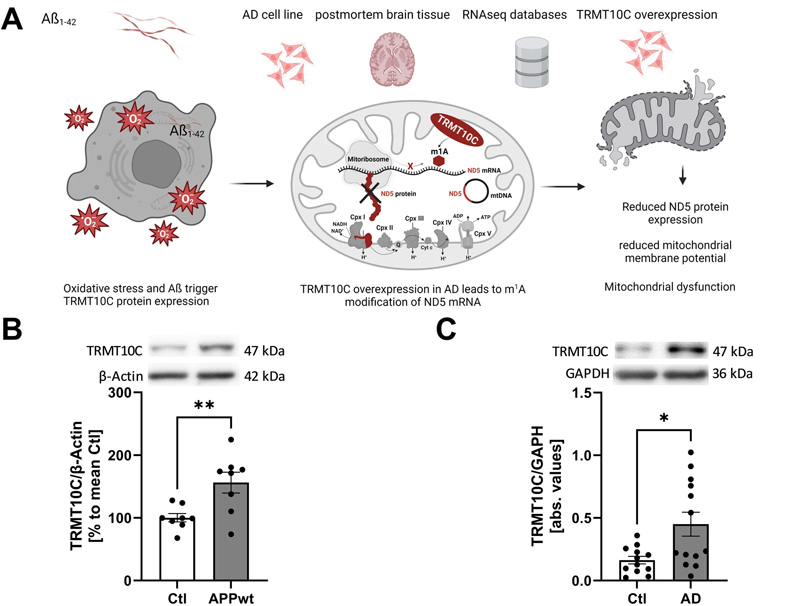
圖2 TRMT10C蛋白和mRNA水平在AD細(xì)胞和動(dòng)物模型以及AD患者的皮層樣本中增加
TRMT10C酶引起甲基化,從而抑制ND5的合成
美因茨大學(xué)制藥和生物醫(yī)學(xué)科學(xué)研究所的弗里德蘭和赫爾姆團(tuán)隊(duì)能夠證明,是一種名為TRMT10C的酶誘導(dǎo)了這種甲基化,從而隨后抑制了ND5。研究人員在合適的細(xì)胞模型和阿爾茨海默病患者的大腦中觀察到ND5亞基蛋白質(zhì)的生物合成受到抑制。
正如作者在《分子精神病學(xué)》上發(fā)表的文章中所述:“因此,我們首次證明,TRMT10C誘導(dǎo)ND5 mRNA的m1A甲基化導(dǎo)致線粒體功能障礙。我們的研究結(jié)果表明,這種新發(fā)現(xiàn)的機(jī)制可能與a β誘導(dǎo)的線粒體功能障礙有關(guān)。”該研究由Transregio 319合作研究中心“RMaP: RNA修飾和加工”的一部分資助。
參考資料
[1] N1-methylation of adenosine (m1A) in ND5 mRNA leads to complex I dysfunction in Alzheimer’s disease
摘要:研究人員已經(jīng)確定了導(dǎo)致阿爾茨海默病患者線粒體功能障礙的機(jī)制。
美因茨約翰內(nèi)斯·古騰堡大學(xué)(JGU)的一組研究人員已經(jīng)確定了導(dǎo)致阿爾茨海默病患者線粒體功能障礙的機(jī)制,從而導(dǎo)致大腦能量供應(yīng)減少。JGU制藥和生物醫(yī)學(xué)科學(xué)研究所的克里斯蒂娜·弗里德蘭教授說(shuō):“這種效應(yīng)可歸因于一種以前未被報(bào)道過(guò)的RNA修飾。”她與同事Mark Helm教授合作指導(dǎo)了相關(guān)研究。他們的研究結(jié)果有助于更好地理解阿爾茨海默病的病理生理學(xué)。美因茨大學(xué)醫(yī)學(xué)中心、分子生物學(xué)研究所、洛林大學(xué)和維也納醫(yī)科大學(xué)的研究小組也參與了這項(xiàng)研究。相應(yīng)的論文發(fā)表在《分子精神病學(xué)》上。

圖1 ND5 mRNA中腺苷(m1A)的N1甲基化導(dǎo)致阿爾茨海默病的復(fù)合物I功能障礙
受功能紊亂影響的“細(xì)胞發(fā)電站”
線粒體通常被稱為細(xì)胞的動(dòng)力源,是細(xì)胞內(nèi)的細(xì)胞器,負(fù)責(zé)向全身尤其是大腦提供能量。大腦95%的能量依賴于線粒體中的葡萄糖代謝。人們?cè)缇椭溃咸烟谴x障礙發(fā)生在阿爾茨海默病的早期階段。這種損傷是由于衰老過(guò)程和β淀粉樣蛋白的積累引起的線粒體功能失調(diào)。
三磷酸腺苷(ATP)形式的能量來(lái)源通過(guò)呼吸鏈的一系列反應(yīng)在線粒體內(nèi)膜形成。參與這一過(guò)程的有一千多種蛋白質(zhì),它們從細(xì)胞核運(yùn)輸?shù)骄€粒體。“但也有一些蛋白質(zhì)是由線粒體自己合成的。其中之一是ND5,它是呼吸鏈復(fù)合體I的一個(gè)亞基,”克里斯蒂娜·弗里德蘭教授解釋說(shuō)。一種叫做NADH的物質(zhì)給復(fù)合體I提供電子,復(fù)合體I將電子轉(zhuǎn)移給泛醌,產(chǎn)生泛醇。在這個(gè)過(guò)程中,四種蛋白質(zhì)從基質(zhì)中被泵入膜間空間。ND5在這一聯(lián)系中起著重要作用,該亞基的線粒體編碼基因的任何突變都可能導(dǎo)致嚴(yán)重的線粒體疾病,如Leigh綜合征。
已經(jīng)證明,為這種蛋白質(zhì)的合成提供指令的mRNA可以經(jīng)歷甲基化。在體細(xì)胞中,mRNA攜帶遺傳信息,并與tRNA一起負(fù)責(zé)將遺傳信息翻譯成蛋白質(zhì)。mRNA的甲基化導(dǎo)致其化學(xué)結(jié)構(gòu)的改變,使其不能再正確地與tRNA相互作用。弗里德蘭補(bǔ)充說(shuō):“合成過(guò)程被破壞,形成的ND5亞基蛋白質(zhì)更少,而ND5是復(fù)合物I的核心相關(guān)蛋白,因?yàn)檎麄€(gè)過(guò)程始于呼吸鏈。”

圖2 TRMT10C蛋白和mRNA水平在AD細(xì)胞和動(dòng)物模型以及AD患者的皮層樣本中增加
TRMT10C酶引起甲基化,從而抑制ND5的合成
美因茨大學(xué)制藥和生物醫(yī)學(xué)科學(xué)研究所的弗里德蘭和赫爾姆團(tuán)隊(duì)能夠證明,是一種名為TRMT10C的酶誘導(dǎo)了這種甲基化,從而隨后抑制了ND5。研究人員在合適的細(xì)胞模型和阿爾茨海默病患者的大腦中觀察到ND5亞基蛋白質(zhì)的生物合成受到抑制。
正如作者在《分子精神病學(xué)》上發(fā)表的文章中所述:“因此,我們首次證明,TRMT10C誘導(dǎo)ND5 mRNA的m1A甲基化導(dǎo)致線粒體功能障礙。我們的研究結(jié)果表明,這種新發(fā)現(xiàn)的機(jī)制可能與a β誘導(dǎo)的線粒體功能障礙有關(guān)。”該研究由Transregio 319合作研究中心“RMaP: RNA修飾和加工”的一部分資助。
參考資料
[1] N1-methylation of adenosine (m1A) in ND5 mRNA leads to complex I dysfunction in Alzheimer’s disease



