摘要:布法羅大學(xué)(University at Buffalo)的研究人員及其合作者已經(jīng)開發(fā)出強(qiáng)大的新方法,來研究并可能逆轉(zhuǎn)導(dǎo)致線粒體疾病和過早衰老的細(xì)胞機(jī)制。
布法羅大學(xué)的研究人員和他們的合作者已經(jīng)開發(fā)出強(qiáng)大的新方法來研究并可能逆轉(zhuǎn)導(dǎo)致線粒體疾病和過早衰老的細(xì)胞機(jī)制。
線粒體提供了細(xì)胞正常運(yùn)作所需的大部分能量,所以線粒體的基因缺陷可能會(huì)導(dǎo)致嚴(yán)重的疾病,如果不及早發(fā)現(xiàn)和治療,這些疾病可能是毀滅性的。
但是這些線粒體缺陷究竟是如何導(dǎo)致疾病和衰老的還沒有被很好地理解。發(fā)表在《衰老細(xì)胞》雜志上的一篇論文揭示了衰老過程中線粒體缺陷和關(guān)鍵信號(hào)之間的聯(lián)系。在《自然通訊》雜志的另一篇論文中,研究人員描述了他們基于光遺傳學(xué)開發(fā)的一項(xiàng)新技術(shù)如何幫助異常的線粒體相互作用恢復(fù)正常功能。

圖1 早衰與高水平的8-氧代鳥嘌呤和DNA損傷增加正相關(guān)(圖源:[1])
線粒體和端粒
《衰老細(xì)胞》的論文將線粒體功能障礙與端粒縮短聯(lián)系起來,端粒縮短是早衰的關(guān)鍵生物標(biāo)志物。
布法羅大學(xué)雅各布斯醫(yī)學(xué)和生物醫(yī)學(xué)科學(xué)學(xué)院兒科遺傳學(xué)系主任、醫(yī)學(xué)博士Taosheng Huang教授解釋說:“端粒是一種特殊的DNA序列,起到了穩(wěn)定染色體末端的帽子的作用。”
“端粒縮短通常被認(rèn)為是衰老的重要生物標(biāo)志物,但長(zhǎng)期以來,沒有人知道其機(jī)制。現(xiàn)在我們能夠?qū)⒕€粒體功能障礙與端粒縮短直接聯(lián)系起來,”該論文的資深作者黃說。
實(shí)驗(yàn)是用一種名為Polg“mutator”的小鼠模型進(jìn)行的,這種小鼠攜帶一種特定的基因缺陷,可以加速線粒體DNA突變的速度。
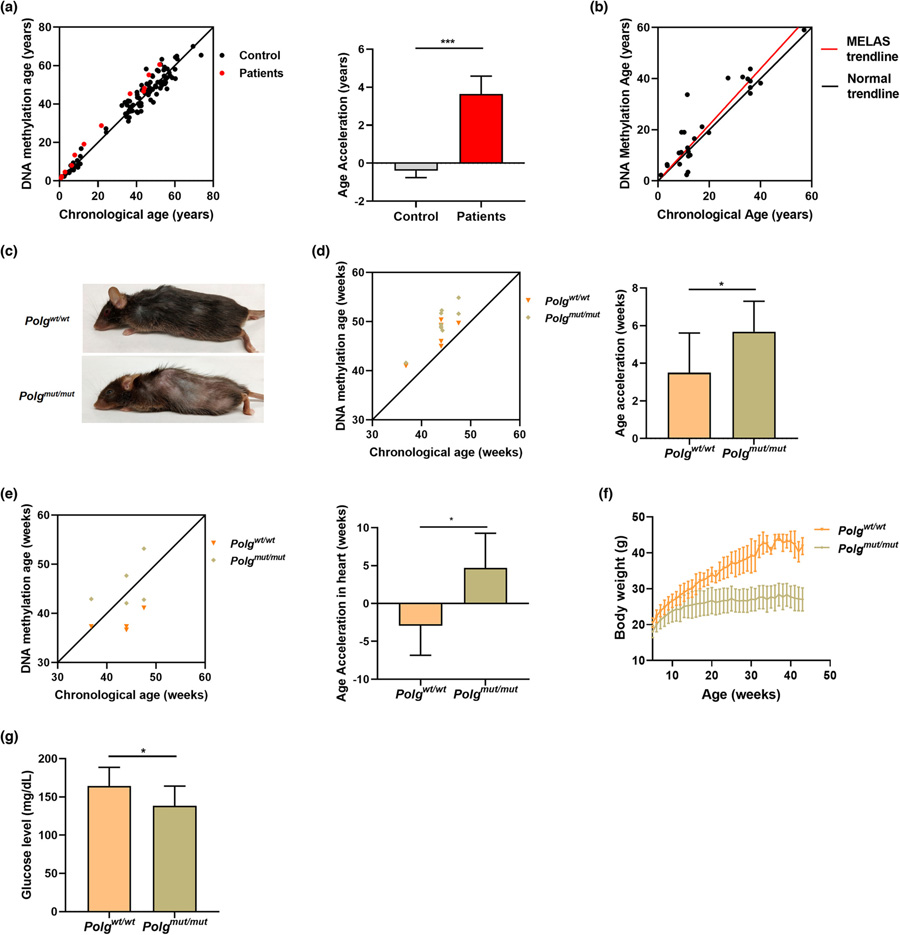
圖2 致病性線粒體DNA突變加速了衰老。
Taosheng Huang教授說:“我們還能夠在人類身上證明,線粒體DNA中一個(gè)核苷酸的變化是如何加速衰老的,這種變化與線粒體功能低下和導(dǎo)致兒童線粒體疾病有關(guān)。”“我們發(fā)現(xiàn),隨著時(shí)間的推移,線粒體功能低下導(dǎo)致的活性氧會(huì)增加DNA損傷。”
這篇論文表明,在這個(gè)模型中,線粒體DNA突變會(huì)產(chǎn)生更快的衰老,正如DNA時(shí)鐘所顯示的那樣,它根據(jù)DNA中的特定化學(xué)標(biāo)記來估計(jì)一個(gè)人的生物年齡。
這項(xiàng)研究是所有作者成功合作的結(jié)果,包括加州大學(xué)洛杉磯分校人類遺傳學(xué)和生物統(tǒng)計(jì)學(xué)教授Steve Horvath博士,他開發(fā)了DNA鐘,以及匹茲堡大學(xué)副教授Patricia Opresko博士和曼尼托巴大學(xué)的Sabine Mai博士,他們都是端粒和端粒損傷方面的專家。
這項(xiàng)研究是由國(guó)家環(huán)境與職業(yè)健康研究所和國(guó)家老齡化研究所資助的,這兩家機(jī)構(gòu)都是國(guó)家健康研究所。
組織細(xì)胞間的相互作用
7月25日,《自然通訊》雜志發(fā)表了一篇論文,揭示了光遺傳學(xué)是如何利用光來操縱細(xì)胞活動(dòng)的,它不僅可以被用作研究工具,還可以被用作實(shí)時(shí)協(xié)調(diào)細(xì)胞器相互作用的工具。

圖3 通過線粒體-溶酶體接觸的光遺傳學(xué)控制光激活線粒體分裂(圖源:[2])
這篇論文的重點(diǎn)是線粒體動(dòng)力學(xué),這些細(xì)胞器不斷經(jīng)歷的過程,以保持細(xì)胞內(nèi)的健康平衡。它們會(huì)發(fā)生裂變,一個(gè)線粒體分裂成兩個(gè),以及融合,兩個(gè)線粒體融合成一個(gè)。細(xì)胞中這兩種過程之間的不平衡會(huì)導(dǎo)致線粒體疾病。
Taosheng Huang說,“在《自然通訊》的論文中,我們描述了一項(xiàng)我們開發(fā)的技術(shù),該技術(shù)允許我們直接操縱線粒體和細(xì)胞中其他細(xì)胞器之間的相互作用”。
“通過利用光遺傳學(xué)迫使線粒體和另一細(xì)胞成分溶酶體之間產(chǎn)生物理作用,我們能夠恢復(fù)線粒體到更正常的大小,同時(shí)改善它們的能量生產(chǎn)功能,我們相信,這項(xiàng)新發(fā)現(xiàn)可以作為這類疾病未來診斷和治療的基礎(chǔ)。”
這項(xiàng)工作是由于使用了辛辛那提大學(xué)的一種強(qiáng)大的成像技術(shù)——結(jié)構(gòu)照明顯微鏡(SIM)而得以實(shí)現(xiàn)的,黃在辛辛那提大學(xué)擔(dān)任現(xiàn)任研究員之前就開始了這項(xiàng)研究。SIM允許對(duì)活細(xì)胞進(jìn)行極高分辨率的實(shí)時(shí)成像。
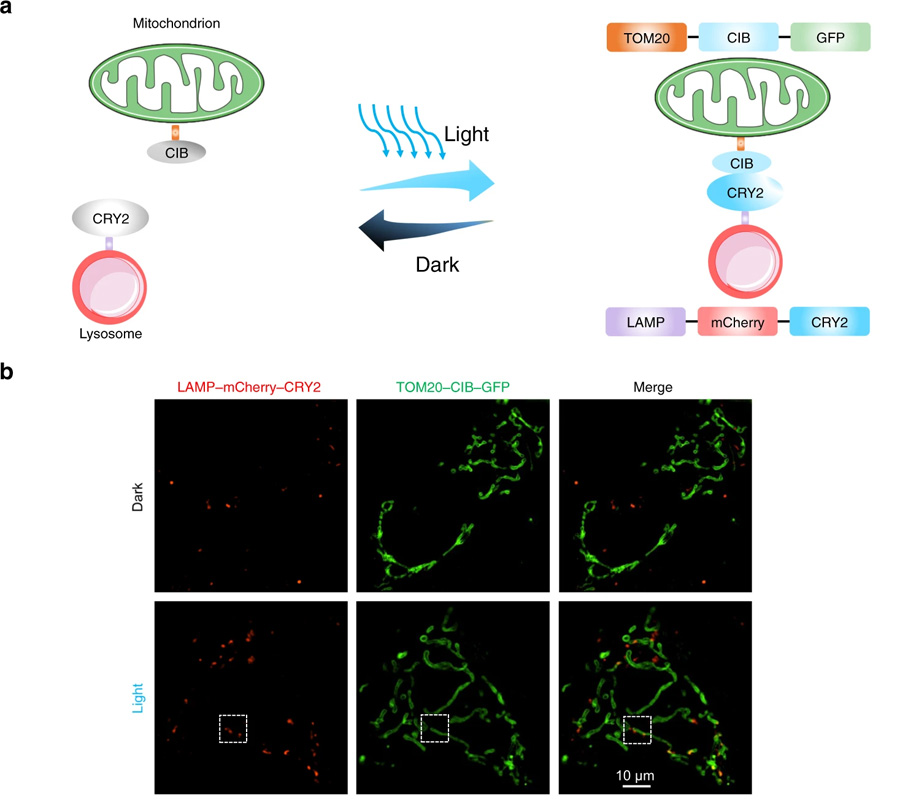
圖4 光遺傳學(xué)可用于誘導(dǎo)線粒體-溶酶體接觸(圖源:[2])
Taosheng Huang是一名線粒體疾病遺傳學(xué)方面的專家,在檢測(cè)和治療遺傳疾病方面開創(chuàng)了開創(chuàng)性的創(chuàng)新。他于2020年從辛辛那提兒童醫(yī)院醫(yī)療中心被招募到UB和John R. Oishei兒童醫(yī)院。他同時(shí)也是奧賽兒童醫(yī)院遺傳與代謝科的醫(yī)學(xué)主任,以及UBMD兒科的人類遺傳學(xué)主任。
《自然通訊》雜志這篇論文的共同作者來自辛辛那提大學(xué)醫(yī)學(xué)院、辛辛那提兒童醫(yī)院醫(yī)學(xué)中心和伊利諾伊大學(xué)厄巴納-香檳分校。這項(xiàng)研究由美國(guó)國(guó)立衛(wèi)生研究院資助。
參考資料:
[1]Premature aging is associated with higher levels of 8-oxoguanine and increased DNA damage in the Polg mutator mouse
[2]Light-activated mitochondrial fission through optogenetic control of mitochondria-lysosome contacts
[2]Light-activated mitochondrial fission through optogenetic control of mitochondria-lysosome contacts
摘要:布法羅大學(xué)(University at Buffalo)的研究人員及其合作者已經(jīng)開發(fā)出強(qiáng)大的新方法,來研究并可能逆轉(zhuǎn)導(dǎo)致線粒體疾病和過早衰老的細(xì)胞機(jī)制。
布法羅大學(xué)的研究人員和他們的合作者已經(jīng)開發(fā)出強(qiáng)大的新方法來研究并可能逆轉(zhuǎn)導(dǎo)致線粒體疾病和過早衰老的細(xì)胞機(jī)制。
線粒體提供了細(xì)胞正常運(yùn)作所需的大部分能量,所以線粒體的基因缺陷可能會(huì)導(dǎo)致嚴(yán)重的疾病,如果不及早發(fā)現(xiàn)和治療,這些疾病可能是毀滅性的。
但是這些線粒體缺陷究竟是如何導(dǎo)致疾病和衰老的還沒有被很好地理解。發(fā)表在《衰老細(xì)胞》雜志上的一篇論文揭示了衰老過程中線粒體缺陷和關(guān)鍵信號(hào)之間的聯(lián)系。在《自然通訊》雜志的另一篇論文中,研究人員描述了他們基于光遺傳學(xué)開發(fā)的一項(xiàng)新技術(shù)如何幫助異常的線粒體相互作用恢復(fù)正常功能。

圖1 早衰與高水平的8-氧代鳥嘌呤和DNA損傷增加正相關(guān)(圖源:[1])
線粒體和端粒
《衰老細(xì)胞》的論文將線粒體功能障礙與端粒縮短聯(lián)系起來,端粒縮短是早衰的關(guān)鍵生物標(biāo)志物。
布法羅大學(xué)雅各布斯醫(yī)學(xué)和生物醫(yī)學(xué)科學(xué)學(xué)院兒科遺傳學(xué)系主任、醫(yī)學(xué)博士Taosheng Huang教授解釋說:“端粒是一種特殊的DNA序列,起到了穩(wěn)定染色體末端的帽子的作用。”
“端粒縮短通常被認(rèn)為是衰老的重要生物標(biāo)志物,但長(zhǎng)期以來,沒有人知道其機(jī)制。現(xiàn)在我們能夠?qū)⒕€粒體功能障礙與端粒縮短直接聯(lián)系起來,”該論文的資深作者黃說。
實(shí)驗(yàn)是用一種名為Polg“mutator”的小鼠模型進(jìn)行的,這種小鼠攜帶一種特定的基因缺陷,可以加速線粒體DNA突變的速度。

圖2 致病性線粒體DNA突變加速了衰老。
Taosheng Huang教授說:“我們還能夠在人類身上證明,線粒體DNA中一個(gè)核苷酸的變化是如何加速衰老的,這種變化與線粒體功能低下和導(dǎo)致兒童線粒體疾病有關(guān)。”“我們發(fā)現(xiàn),隨著時(shí)間的推移,線粒體功能低下導(dǎo)致的活性氧會(huì)增加DNA損傷。”
這篇論文表明,在這個(gè)模型中,線粒體DNA突變會(huì)產(chǎn)生更快的衰老,正如DNA時(shí)鐘所顯示的那樣,它根據(jù)DNA中的特定化學(xué)標(biāo)記來估計(jì)一個(gè)人的生物年齡。
這項(xiàng)研究是所有作者成功合作的結(jié)果,包括加州大學(xué)洛杉磯分校人類遺傳學(xué)和生物統(tǒng)計(jì)學(xué)教授Steve Horvath博士,他開發(fā)了DNA鐘,以及匹茲堡大學(xué)副教授Patricia Opresko博士和曼尼托巴大學(xué)的Sabine Mai博士,他們都是端粒和端粒損傷方面的專家。
這項(xiàng)研究是由國(guó)家環(huán)境與職業(yè)健康研究所和國(guó)家老齡化研究所資助的,這兩家機(jī)構(gòu)都是國(guó)家健康研究所。
組織細(xì)胞間的相互作用
7月25日,《自然通訊》雜志發(fā)表了一篇論文,揭示了光遺傳學(xué)是如何利用光來操縱細(xì)胞活動(dòng)的,它不僅可以被用作研究工具,還可以被用作實(shí)時(shí)協(xié)調(diào)細(xì)胞器相互作用的工具。

圖3 通過線粒體-溶酶體接觸的光遺傳學(xué)控制光激活線粒體分裂(圖源:[2])
這篇論文的重點(diǎn)是線粒體動(dòng)力學(xué),這些細(xì)胞器不斷經(jīng)歷的過程,以保持細(xì)胞內(nèi)的健康平衡。它們會(huì)發(fā)生裂變,一個(gè)線粒體分裂成兩個(gè),以及融合,兩個(gè)線粒體融合成一個(gè)。細(xì)胞中這兩種過程之間的不平衡會(huì)導(dǎo)致線粒體疾病。
Taosheng Huang說,“在《自然通訊》的論文中,我們描述了一項(xiàng)我們開發(fā)的技術(shù),該技術(shù)允許我們直接操縱線粒體和細(xì)胞中其他細(xì)胞器之間的相互作用”。
“通過利用光遺傳學(xué)迫使線粒體和另一細(xì)胞成分溶酶體之間產(chǎn)生物理作用,我們能夠恢復(fù)線粒體到更正常的大小,同時(shí)改善它們的能量生產(chǎn)功能,我們相信,這項(xiàng)新發(fā)現(xiàn)可以作為這類疾病未來診斷和治療的基礎(chǔ)。”
這項(xiàng)工作是由于使用了辛辛那提大學(xué)的一種強(qiáng)大的成像技術(shù)——結(jié)構(gòu)照明顯微鏡(SIM)而得以實(shí)現(xiàn)的,黃在辛辛那提大學(xué)擔(dān)任現(xiàn)任研究員之前就開始了這項(xiàng)研究。SIM允許對(duì)活細(xì)胞進(jìn)行極高分辨率的實(shí)時(shí)成像。

圖4 光遺傳學(xué)可用于誘導(dǎo)線粒體-溶酶體接觸(圖源:[2])
Taosheng Huang是一名線粒體疾病遺傳學(xué)方面的專家,在檢測(cè)和治療遺傳疾病方面開創(chuàng)了開創(chuàng)性的創(chuàng)新。他于2020年從辛辛那提兒童醫(yī)院醫(yī)療中心被招募到UB和John R. Oishei兒童醫(yī)院。他同時(shí)也是奧賽兒童醫(yī)院遺傳與代謝科的醫(yī)學(xué)主任,以及UBMD兒科的人類遺傳學(xué)主任。
《自然通訊》雜志這篇論文的共同作者來自辛辛那提大學(xué)醫(yī)學(xué)院、辛辛那提兒童醫(yī)院醫(yī)學(xué)中心和伊利諾伊大學(xué)厄巴納-香檳分校。這項(xiàng)研究由美國(guó)國(guó)立衛(wèi)生研究院資助。
參考資料:
[1]Premature aging is associated with higher levels of 8-oxoguanine and increased DNA damage in the Polg mutator mouse
[2]Light-activated mitochondrial fission through optogenetic control of mitochondria-lysosome contacts
[2]Light-activated mitochondrial fission through optogenetic control of mitochondria-lysosome contacts



