2022年3月15日,西湖大學(xué)生命科學(xué)與生物醫(yī)學(xué)實(shí)驗(yàn)室團(tuán)隊(duì)在Cell Reports Medicine發(fā)表了題為“Multi-omics in COVID-19:Seeing the unseen but overlooked in the clinic”的文章(圖1)[1]。

圖1 研究成果(圖源:Cell Reports Medicine)
截至2022年2月12日,200多國和地區(qū)報(bào)告了超過4.05億例COVID-19確診病例及580萬例死亡病例。雖然疫苗接種并沒能阻止SARS-CoV-2的傳播,但卻降低了成人和兒童感染后發(fā)展成重癥或死亡的風(fēng)險(xiǎn)。多組學(xué)技術(shù)研究揭示了病原體的分子特征與結(jié)構(gòu),以及宿主對病毒感染和疫苗接種后反應(yīng)的潛在分子機(jī)制(圖2和圖3)。
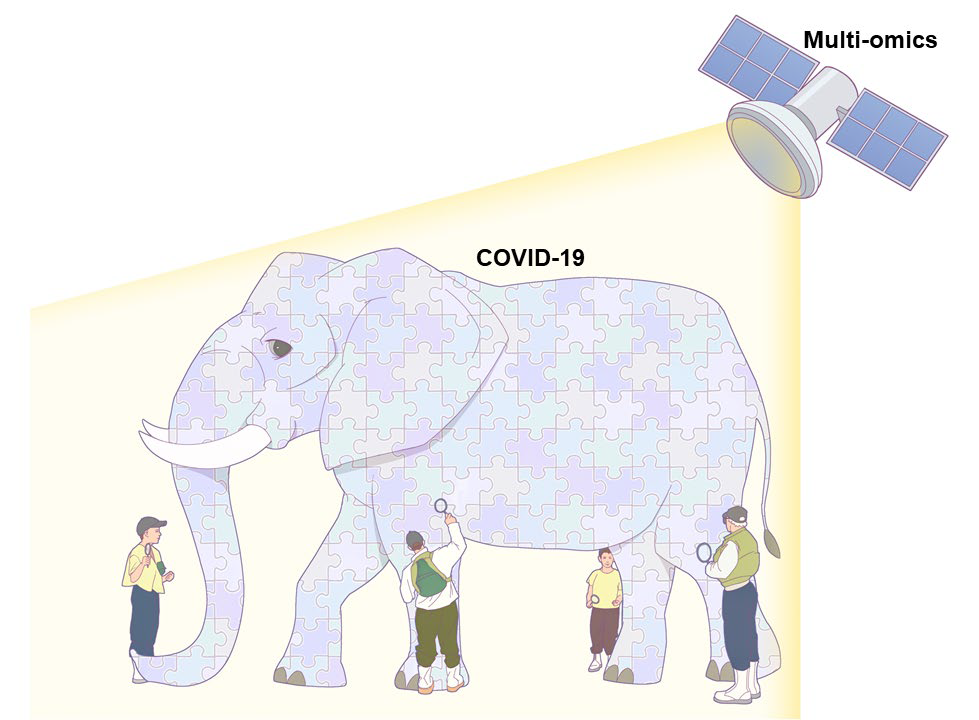
圖2 多組學(xué)能夠系統(tǒng)地表征COVID-19中的分子調(diào)節(jié)(圖源:Cell Reports Medicine)
注:大象指的是COVID-19患者,而放大鏡指用于檢查有限分子數(shù)量的傳統(tǒng)技術(shù)。多組學(xué)技術(shù),就像衛(wèi)星一樣,可以分析分子調(diào)控機(jī)制,其中大部分是放大鏡看不到的東西。
一、病原體
多組學(xué)技術(shù)極大加深了我們對SARS-CoV-2以及宿主反應(yīng)的理解,這些技術(shù)包括但不限于第二代測序(Next-Generation Sequencing,NGS)、蛋白質(zhì)組學(xué)和代謝組學(xué)(圖 3)。事實(shí)上,新冠大流行病原體的確定還需要?dú)w功于基因組學(xué)。基于這個(gè)結(jié)果,人們開發(fā)了PCR試劑盒,并將之迅速應(yīng)用于臨床,取代了原始的體溫檢測法,有效提高了COVID-19診斷的準(zhǔn)確性。
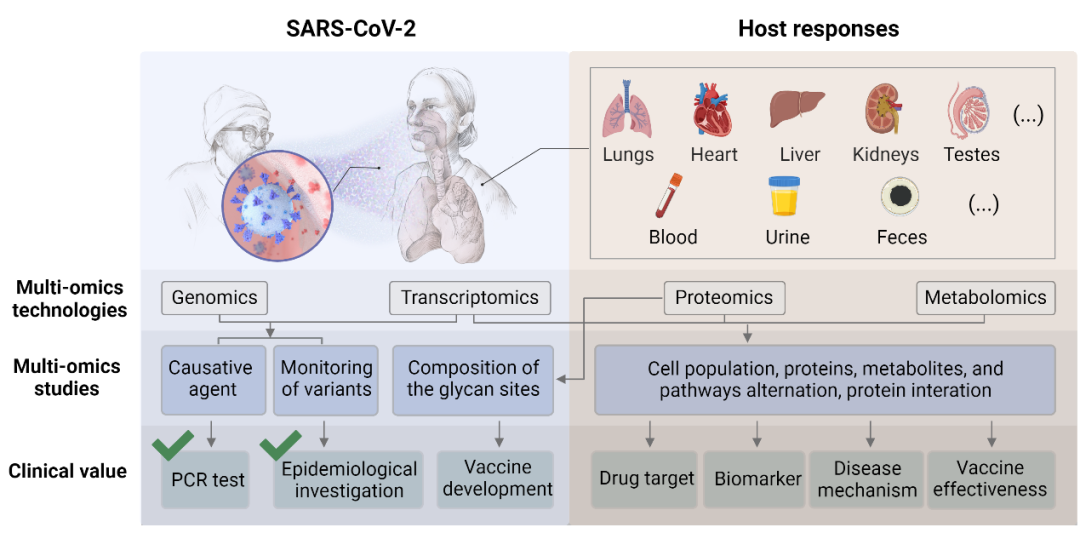
關(guān)于SARS-CoV-2和宿主反應(yīng)的多組學(xué)研究(圖源:Cell Reports Medicine)
注:改編自由BioRender.com(2022年)撰寫的“SARS-CoV-2關(guān)注變體的潛在傳播機(jī)制”;來源于https://app.biorender.com/biorender-templates;病毒的基因組和蛋白質(zhì)組研究讓人們快速建立了用于COVID-19診斷的PCR檢測方法。基因組的監(jiān)測使我們能夠?qū)Σ《镜倪M(jìn)化和傳播進(jìn)行流行病學(xué)調(diào)查。目前已經(jīng)根序列和表面蛋白設(shè)計(jì)了多種疫苗。大多數(shù)多組學(xué)分析都集中在宿主對感染或疫苗接種的反應(yīng)上,蛋白質(zhì)組學(xué)和代謝組學(xué)是這方面重要的主力軍。
SARS-CoV-2的突變會(huì)導(dǎo)致其致病性、傳染性、傳播性或抗原性的變化。例如,研究發(fā)現(xiàn)E484K是一種免疫逃逸突變,可以減少抗體介導(dǎo)的中和作用。NGS技術(shù)的迅速應(yīng)用不僅有助于Delta和Omicron等突變毒株的發(fā)現(xiàn),而且有助于跟蹤調(diào)查它們在不同地區(qū)的傳播情況[1]。在津巴布韋對SARS-CoV-2變異毒株流行病學(xué)調(diào)查的一項(xiàng)研究中發(fā)現(xiàn),60%的病例是輸入性的,這表明人口流動(dòng)是其傳播的關(guān)鍵因素,進(jìn)一步支持了檢疫和限制人口流動(dòng)的重要性[4]。基于質(zhì)譜(MS)的對新冠病毒刺突(S)糖蛋白質(zhì)的研究也有助于疫苗的研發(fā)。病毒的S蛋白會(huì)與宿主細(xì)胞中的ACE2蛋白產(chǎn)生相互作用,利用這一點(diǎn),抗體通過靶向作用于S蛋白來中和病毒。因此,S蛋白的結(jié)構(gòu),包括其糖基化位點(diǎn),對疫苗的設(shè)計(jì)很關(guān)鍵。Watanabe等人表達(dá)了重組刺突蛋白三聚體,并通過質(zhì)譜確定了22個(gè)糖基化位點(diǎn)的糖基組成(例如,N234和N709位點(diǎn)上糖基主要屬于寡甘露糖型)[4]。這個(gè)研究不僅深化了我們對S蛋白結(jié)構(gòu)的了解,而且還為評(píng)估疫苗和治療性抗體開發(fā)中的免疫原質(zhì)量提供了基準(zhǔn)。
二、宿主對病原體的反應(yīng)
雖然多組學(xué)幫助我們在了解病原體的性質(zhì)和結(jié)構(gòu)上取得了一定的進(jìn)展,但新冠病毒感染患者的癥狀,如哪些患者會(huì)發(fā)展成重癥,仍然難以預(yù)測。如果有一種實(shí)用的方法來根據(jù)疾病嚴(yán)重程度對患者進(jìn)行分類,并確定那些能在SARS-CoV-2感染中幸存下來的大多數(shù)患者,那么許多對全球大流行的擔(dān)憂就可以得到緩解。此外,不同人群對新出現(xiàn)的突變毒株的免疫反應(yīng)是否存在差異?不同的疫苗和接種次數(shù)是如何影響人體對SARS-CoV-2的免疫力的?要解決這些問題及許多其他關(guān)鍵問題,我們需要了解宿主對這種病原體及其疫苗的反應(yīng)。大多數(shù)多組學(xué)研究能夠基于多種器官和臨床標(biāo)本,探究宿主對病原體的成千上萬種分子變化,這是傳統(tǒng)的方法難以實(shí)現(xiàn)的。
COVID-19宿主反應(yīng)研究開始僅限于觀察如發(fā)燒和咳嗽等的臨床癥狀,進(jìn)一步延伸到觀察胸部CT及如CRP和SAA1等的循環(huán)蛋白生物標(biāo)志物指標(biāo)的變化。這些標(biāo)志物已用于其他傳染病的觀察,基于這些經(jīng)驗(yàn),它們也被用于監(jiān)測COVID-19的臨床進(jìn)展。多組學(xué)研究監(jiān)測了人體內(nèi)大量由于感染新冠發(fā)生改變的分子,極大地拓展?jié)撛诘臉?biāo)志物種類,這些發(fā)現(xiàn)通常難以用傳統(tǒng)的分析方法檢測到(圖3)。例如,基于COVID-19患者血清的蛋白質(zhì)組學(xué)和代謝組學(xué)研究已有效地應(yīng)用于測量約2000個(gè)血液中的分子,其中93種蛋白質(zhì)和204種代謝物在重癥患者中表現(xiàn)出顯著的特異性失調(diào)。該研究還強(qiáng)調(diào)了血小板脫顆粒、巨噬細(xì)胞和補(bǔ)體系統(tǒng)的關(guān)鍵作用。大多數(shù)關(guān)鍵分子變化已在多國/地區(qū)的其他新冠多組學(xué)研究中得到證實(shí),驗(yàn)證了蛋白質(zhì)組學(xué)和代謝組學(xué)技術(shù)的可靠性以及他們在臨床決策中的潛在價(jià)值[4]。
值得一提的是,尿液作為一種非侵入性的臨床生物標(biāo)本,其中包含的蛋白質(zhì)和小分子代謝物也可以很容易地被質(zhì)譜檢測到。研究人員在尿液中檢測到了近4000種蛋白質(zhì),而由于血清中高豐度蛋白質(zhì)的存在,使用相同的質(zhì)譜方法僅能檢測到約1500種蛋白質(zhì)。值得注意的是,可在血清中檢測到的蛋白有80%可在尿液中檢測到,而在尿液中檢測到的蛋白僅有31%可以在血清中檢測到[6]。
為什么我們需要檢測這些分子呢?這些發(fā)現(xiàn)對抗疫有何幫助?多項(xiàng)組學(xué)研究表明,在經(jīng)過合理設(shè)計(jì)的組學(xué)實(shí)驗(yàn)中,機(jī)器學(xué)習(xí)可以篩查用于分類和監(jiān)測疾病進(jìn)展的生物標(biāo)志物。例如,基于血清中表達(dá)的22種蛋白質(zhì)和7種代謝物的隨機(jī)森林模型可以可靠地指示 COVID-19的嚴(yán)重程度,并在一定程度上預(yù)測疾病預(yù)后。4同樣,基于尿液蛋白的模型也可用于監(jiān)測COVID-19疾病進(jìn)展[6]。
除了血液中的循環(huán)分子外,其他器官中的分子變化對于揭示宿主反應(yīng)也至關(guān)重要。病理切片檢查在宏觀和微觀層面為診斷提供了豐富的信息,被廣泛認(rèn)可為疾病診斷的“金標(biāo)準(zhǔn)”。然而,在新冠患者的多器官病理切片中觀察到的改變與非典型性肺炎(SARS)和中東呼吸綜合征(MERS)患者中呈現(xiàn)的的組織病理學(xué)區(qū)別并不明顯,而是高度相似。基于質(zhì)譜的蛋白質(zhì)組學(xué)現(xiàn)在能夠在多器官尸檢樣品中表征超過10000種蛋白質(zhì),并發(fā)現(xiàn)了參與凝血,血管生成,纖維化和脂肪酸代謝等過程的多種失調(diào)蛋白質(zhì)[7]。
如果沒有這樣的高深度的蛋白質(zhì)組學(xué)技術(shù),而使用基于假設(shè)的研究方法來探索新冠感染后人體的變化,那么目前已知的幾個(gè)重要發(fā)現(xiàn),如肺部組織蛋白酶L(Cathepsin L)的上調(diào)與COVID-19死亡率之間存在潛在聯(lián)系或INSL3蛋白減少與睪丸中間質(zhì)細(xì)胞受損之間的關(guān)聯(lián),將耗費(fèi)無法估量的精力與時(shí)間[8]。蛋白質(zhì)組學(xué)使我們能夠“看到”病理表現(xiàn)背后的分子變化。患者的組織標(biāo)本,特別是肺組織,可能具有傳染性,在分析之前必須進(jìn)行滅活,這通常通過福爾馬林固定來實(shí)現(xiàn),而其通常會(huì)導(dǎo)致mRNA降解,使得基于福爾馬林固定的樣本的轉(zhuǎn)錄組學(xué)分析存在挑戰(zhàn)性。相比之下,蛋白可以被有效地從福爾馬林固定的組織中提取,然后進(jìn)行質(zhì)譜分析[9]。
組學(xué)技術(shù)還能夠發(fā)現(xiàn)病毒的靶細(xì)胞,這是傳統(tǒng)技術(shù)難以實(shí)現(xiàn)的。鼻咽拭子的單細(xì)胞RNA 測序(single-cell RNA sequencing,scRNA-seq)顯示,在COVID-19感染期間,咽部的纖毛細(xì)胞(ciliated cell)減少,同時(shí)分泌細(xì)胞(secretory cell)、次胞質(zhì)體 (deuterosomal cell)擴(kuò)增和巨噬細(xì)胞(macrophages)增加。沒有其他技術(shù)可以替代單細(xì)胞RNA測序直接從臨床標(biāo)本中獲得這樣的結(jié)果[10]。不僅如此,scRNA-seq也可以用于解碼同種細(xì)胞的多種亞細(xì)胞群。例如,淋巴細(xì)胞減少癥(血液中循環(huán)淋巴細(xì)胞的顯著減少)是COVID-19患者的常見癥狀。各種淋巴細(xì)胞在抗病毒免疫中發(fā)揮著不同的作用,基于這些淋巴細(xì)胞的scRNA-seq研究發(fā)現(xiàn)了三種不同淋巴細(xì)胞亞細(xì)胞群響應(yīng)模式與患者的預(yù)后有關(guān)[11]。
三、對疫苗的反應(yīng)
多組學(xué)研究還可能為疫苗的使用提供指導(dǎo)意見,盡管這些數(shù)據(jù)目前尚不夠多。全球已接種超過100億劑疫苗,包括mRNA疫苗、滅活病毒疫苗和基于腺病毒的疫苗等。雖然所有疫苗都對預(yù)防SARS-CoV-2感染起到了一定的保護(hù)作用,但mRNA疫苗被證實(shí)比其他疫苗帶來了更高的中和抗體滴度。然而,這種保護(hù)作用不僅通過中和抗體起作用,而且還由其他免疫效應(yīng)機(jī)制介導(dǎo),包括T細(xì)胞和先天免疫細(xì)胞[12]。例如,在沒有檢測到中和抗體的情況下,即使只接種一劑,mRNA疫苗對預(yù)防感染也達(dá)到了80%的有效性。11此外,高達(dá)6%的被接種人在第二次注射后血清中仍然檢測不到中和抗體。
據(jù)美國疾控中心報(bào)道,截至2022年2月12日,超過0.004%的被接種人出現(xiàn)了嚴(yán)重的副作用,包括過敏反應(yīng)、血栓形成伴血小板減少綜合征、吉蘭-巴雷綜合征甚至死亡[12]。中和抗體的濃度隨時(shí)間推移而下降,突破性感染時(shí)有發(fā)生,尤其是當(dāng)面對新興的免疫逃逸突變毒株如Omicron時(shí)。迄今為止,針對特定突變毒株的定制疫苗尚未出現(xiàn),盡管其在預(yù)防COVID-19方面具有不可否認(rèn)的重要性[13]。解決疫苗的保護(hù)性免疫不確定性的一項(xiàng)有爭議但務(wù)實(shí)的政策是強(qiáng)制加強(qiáng)疫苗的接種。

疫苗接種的這些局限性,是目前多國數(shù)億被接種人次所遇到的普遍問題。理論上,通過實(shí)時(shí)監(jiān)測血清抗體含量變化可以為人群的流行病學(xué)追蹤提供信息,更重要的是,可能為指導(dǎo)疫苗劑量和接種間隔提供有用的信息。然而,即使是中和抗體的檢測也沒有被廣泛用于指導(dǎo)臨床決策,這可能是因?yàn)榇笠?guī)模血液采樣的可行性有限,并且缺乏通用的標(biāo)準(zhǔn)流程。監(jiān)測尿蛋白的變化可能是評(píng)估對病毒免疫力的更實(shí)際的手段,但是,目前也還沒有相關(guān)的數(shù)據(jù)公布。
四、為什么臨床實(shí)踐很大程度上忽視了蛋白質(zhì)組學(xué)和代謝組學(xué)?
雖然已經(jīng)發(fā)表的與COVID-19相關(guān)的組學(xué)論文已有近10000篇(截至2022年2月12日的PubMed搜索),但除了PCR和病毒的基因組分析外,大部分組學(xué)研究的結(jié)果尚未成功進(jìn)入COVID-19的臨床應(yīng)用。一個(gè)可能的原因是,人們的認(rèn)知中多組學(xué)技術(shù)還不成熟(主要指蛋白質(zhì)組學(xué)和代謝組學(xué)),重復(fù)性和可靠性不高,無法提供臨床上可靠的結(jié)果。
然而,近期世界各地的多個(gè)實(shí)驗(yàn)室發(fā)表的蛋白質(zhì)組學(xué)數(shù)據(jù)在失調(diào)的分子的種類和變化趨勢上顯示出驚人的一致。相比之下,眾所周知的是假陰性在SARS-CoV-2的PCR檢測中很常見。近期一項(xiàng)針對95919名患者的研究報(bào)告顯示PCR檢測新冠病毒的假陰性率 (False-Nnegative Rate,F(xiàn)NR)和敏感性分別為9.3%(95% CI 1.5–17.0%)和 90.7%(95% CI 82.6–98.9%)。有些人可能會(huì)爭辯說,蛋白質(zhì)太不穩(wěn)定了,在實(shí)際應(yīng)用中難以成為穩(wěn)定可信的生物標(biāo)志物[14]。然而,研究表明,通過質(zhì)譜測量的蛋白質(zhì)比 NGS測量的mRNA更穩(wěn)定[15]。

那是因?yàn)榈鞍踪|(zhì)和代謝物的測量在技術(shù)和分析上太具有挑戰(zhàn)性,而且成本太高嗎?確實(shí),蛋白質(zhì)組學(xué)和代謝組學(xué)數(shù)據(jù)的獲取需要許多步驟,依賴于特殊的專業(yè)知識(shí)和昂貴的儀器。例如,蛋白質(zhì)組學(xué)的數(shù)據(jù)采集依賴于高分辨率質(zhì)譜儀。然而,更復(fù)雜和昂貴的技術(shù)如正電子發(fā)射斷層掃描(Positron Emission Tomography,PET)等已經(jīng)在臨床上廣泛使用,所以這些也不應(yīng)該是不可逾越的障礙。此外,通過質(zhì)譜法測量一種蛋白質(zhì)的成本已從2006年的約3美元降至2020年的不到0.1美元[16]。
蛋白質(zhì)組學(xué)和代謝組學(xué)臨床應(yīng)用的主要障礙可能是缺乏標(biāo)準(zhǔn)化。由于蛋白質(zhì)組學(xué)領(lǐng)域正在快速發(fā)展,不同實(shí)驗(yàn)室?guī)缀醪粫?huì)使用相同的標(biāo)準(zhǔn)操作流程(Standard Operating Protocols,SOP);而代謝組學(xué)的情況更加令人困惑,出于商業(yè)考慮,即使是在不同實(shí)驗(yàn)室中生成的原始數(shù)據(jù)文件也很少得到共享。盡管代謝組學(xué)的商業(yè)化先于蛋白質(zhì)組學(xué)的商業(yè)化,但大多數(shù)代謝組學(xué)平臺(tái)并不公開其開發(fā)的資源(例如,用于分子測量的化合物庫)和技術(shù),甚至在科學(xué)交流中也不共享其原始數(shù)據(jù)。想要實(shí)現(xiàn)必要的透明度和標(biāo)準(zhǔn)化,扭轉(zhuǎn)這種令人氣餒的局面絕非易事。相比之下,蛋白質(zhì)組學(xué)界的狀況更加科學(xué)透明、心態(tài)更加開放共享。我們相信,在不久的將來,通過蛋白質(zhì)組學(xué)科學(xué)家、臨床從業(yè)者和其他利益相關(guān)者的共同努力,可以制定出幾個(gè)能夠獲得國際共識(shí)的用于臨床的蛋白質(zhì)組學(xué)SOP。
五、其他挑戰(zhàn)
整合對相同樣本使用不同組學(xué)方法測量的數(shù)據(jù)對多組學(xué)的臨床應(yīng)用也是一大挑戰(zhàn)。基因組數(shù)據(jù)大多是定性的,而轉(zhuǎn)錄組、蛋白組和代謝組的數(shù)據(jù)大多是定量的。因此,人們很難通過算法直接分析這復(fù)雜多樣的數(shù)據(jù)。此外,與在相同個(gè)體的不同組織之間保持一致的基因組不同,蛋白質(zhì)組和代謝組具有組織特異性和環(huán)境依賴性,能夠反映生理和病理上的復(fù)雜的實(shí)時(shí)狀態(tài),其時(shí)空異質(zhì)性也為數(shù)據(jù)采集和分析帶來很大的挑戰(zhàn)。
除了這些技術(shù)限制之外,在大流行期間收集潛在的傳染性樣本還帶來了額外的挑戰(zhàn)。COVID-19研究中使用的常見樣本是血液或支氣管肺泡灌洗液樣本,而尿液和糞便等非侵入性樣本的數(shù)據(jù)也已逐漸被證明能夠有效反映宿主反應(yīng)。然而,醫(yī)院缺乏用于安全收集和有效預(yù)處理這些樣本的SOP以進(jìn)行多組學(xué)研究,這可能成為隊(duì)列內(nèi)和不同隊(duì)列之間偏倚的來源之一。考慮到生物安全的問題,對COVID-19樣本的獲取有諸多限制,但這也限制了對這些珍貴樣本的進(jìn)行深入研究的可能,從而限制了人們對COVID-19 的探索來發(fā)展有效防疫措施。如果能夠建立適當(dāng)?shù)奶幚砗瞳@取這些潛在傳染性標(biāo)本且技術(shù)上可行的SOP,我們對COVID-19的研究將會(huì)更快地發(fā)展和深入。COVID-19不太可能消失,這也不會(huì)是末次大流行病。因此,人類絕不能自滿于目前所取得的成就。全社會(huì)現(xiàn)在必須采取行動(dòng),為未來做好更好的準(zhǔn)備。
參考文章
[1]Tian Lu, Yingrui Wang, Tiannan Guo, Multi-omics in COVID-19: Seeing the unseen but overlooked in the clinic, Cell Reports Medicine, 2022 Mar;3(3):2666-3791.doi:10.1016/j.xcrm.2022.100580.
[2]Harvey WT, Carabelli AM, Jackson B, et al. COVID-19 Genomics UK (COG-UK) Consortium, Peacock SJ, Robertson DL. SARS-CoV-2 variants, spike mutations and immune escape. Nat Rev Microbiol. 2021 Jul;19(7):409-424. doi: 10.1038/s41579-021-00573-0. Epub 2021 Jun 1. PMID: 34075212; PMCID: PMC8167834.
[3]Mashe T, Takawira FT, de Oliveira Martins L, et al. COVID-19 Genomics UK Consortium; SARS-CoV-2 Research Group. Genomic epidemiology and the role of international and regional travel in the SARS-CoV-2 epidemic in Zimbabwe: a retrospective study of routinely collected surveillance data. Lancet Glob Health. 2021 Dec;9(12):e1658-e1666. doi: 10.1016/S2214-109X(21)00434-4. Epub 2021 Oct 22. PMID: 34695371; PMCID: PMC8536247.
[4]Watanabe, Y., Allen, J.D., Wrapp, D., et al. Site-specific glycan analysis of the SARS-CoV-2 spike. Science 369, 330-333 (2020).
[5]Shen B, Yi X, Sun Y, et al. Proteomic and Metabolomic Characterization of COVID-19 Patient Sera. Cell. 2020 Jul 9;182(1):59-72.e15. doi: 10.1016/j.cell.2020.05.032. Epub 2020 May 28. PMID: 32492406; PMCID: PMC7254001.
[6]Bi X, Liu W, Ding X, et al. Proteomic and metabolomic profiling of urine uncovers immune responses in patients with COVID-19. Cell Rep. 2022 Jan 18;38(3):110271. doi: 10.1016/j.celrep.2021.110271. Epub 2021 Dec 28. PMID: 35026155; PMCID: PMC8712267.
[7]Deshmukh, V., Motwani, R., Kumar, A., et al. Histopathological observations in COVID-19: a systematic review. J Clin Pathol 74, 76-83 (2021).
[8]Nie X, Qian L, Sun R, et al. Multi-organ proteomic landscape of COVID-19 autopsies. Cell. 2021 Feb 4;184(3):775-791.e14. doi: 10.1016/j.cell.2021.01.004. Epub 2021 Jan 9. PMID: 33503446; PMCID: PMC7794601.
[9]Zhu Y, Weiss T, Zhang Q, et al. High-throughput proteomic analysis of FFPE tissue samples facilitates tumor stratification. Mol Oncol. 2019 Nov;13(11):2305-2328. doi: 10.1002/1878-0261.12570. Epub 2019 Sep 18. PMID: 31495056; PMCID: PMC6822243.
[10]Ziegler CGK, Miao VN, Owings AH, et al. Impaired local intrinsic immunity to SARS-CoV-2 infection in severe COVID-19. Cell. 2021 Sep 2;184(18):4713-4733.e22. doi: 10.1016/j.cell.2021.07.023. Epub 2021 Jul 23. PMID: 34352228; PMCID: PMC8299217.
[11]Mathew D, Giles JR, Baxter AE, et al. Deep immune profiling of COVID-19 patients reveals distinct immunotypes with therapeutic implications. Science. 2020 Sep 4;369(6508):eabc8511. doi: 10.1126/science.abc8511. Epub 2020 Jul 15. PMID: 32669297; PMCID: PMC7402624.
[12]Sadarangani, M., Marchant, A. & Kollmann, T.R. Immunological mechanisms of vaccine-induced protection against COVID-19 in humans. Nat Rev Immunol 21, 475-484 (2021).
[13]Kuhlmann C, Mayer CK, Claassen M, et al. Breakthrough infections with SARS-CoV-2 omicron despite mRNA vaccine booster dose. Lancet. 2022 Feb 12;399(10325):625-626. doi: 10.1016/S0140-6736(22)00090-3. Epub 2022 Jan 18. Erratum in: Lancet. 2022 Feb 12;399(10325):628. PMID: 35063123; PMCID: PMC8765759.
[14]Kanji JN, Zelyas N, MacDonald C, et al. False negative rate of COVID-19 PCR testing: a discordant testing analysis. Virol J. 2021 Jan 9;18(1):13. doi: 10.1186/s12985-021-01489-0. PMID: 33422083; PMCID: PMC7794619.
[15]Shao W, Guo T, Toussaint NC, et al. Comparative analysis of mRNA and protein degradation in prostate tissues indicates high stability of proteins. Nat Commun. 2019 Jun 7;10(1):2524. doi: 10.1038/s41467-019-10513-5. PMID: 31175306; PMCID: PMC6555818.
[16]Xiao Q, Zhang F, Xu L, et al. High-throughput proteomics and AI for cancer biomarker discovery. Adv Drug Deliv Rev. 2021 Sep;176:113844. doi: 10.1016/j.addr.2021.113844. Epub 2021 Jun 26. PMID: 34182017.
[2]Harvey WT, Carabelli AM, Jackson B, et al. COVID-19 Genomics UK (COG-UK) Consortium, Peacock SJ, Robertson DL. SARS-CoV-2 variants, spike mutations and immune escape. Nat Rev Microbiol. 2021 Jul;19(7):409-424. doi: 10.1038/s41579-021-00573-0. Epub 2021 Jun 1. PMID: 34075212; PMCID: PMC8167834.
[3]Mashe T, Takawira FT, de Oliveira Martins L, et al. COVID-19 Genomics UK Consortium; SARS-CoV-2 Research Group. Genomic epidemiology and the role of international and regional travel in the SARS-CoV-2 epidemic in Zimbabwe: a retrospective study of routinely collected surveillance data. Lancet Glob Health. 2021 Dec;9(12):e1658-e1666. doi: 10.1016/S2214-109X(21)00434-4. Epub 2021 Oct 22. PMID: 34695371; PMCID: PMC8536247.
[4]Watanabe, Y., Allen, J.D., Wrapp, D., et al. Site-specific glycan analysis of the SARS-CoV-2 spike. Science 369, 330-333 (2020).
[5]Shen B, Yi X, Sun Y, et al. Proteomic and Metabolomic Characterization of COVID-19 Patient Sera. Cell. 2020 Jul 9;182(1):59-72.e15. doi: 10.1016/j.cell.2020.05.032. Epub 2020 May 28. PMID: 32492406; PMCID: PMC7254001.
[6]Bi X, Liu W, Ding X, et al. Proteomic and metabolomic profiling of urine uncovers immune responses in patients with COVID-19. Cell Rep. 2022 Jan 18;38(3):110271. doi: 10.1016/j.celrep.2021.110271. Epub 2021 Dec 28. PMID: 35026155; PMCID: PMC8712267.
[7]Deshmukh, V., Motwani, R., Kumar, A., et al. Histopathological observations in COVID-19: a systematic review. J Clin Pathol 74, 76-83 (2021).
[8]Nie X, Qian L, Sun R, et al. Multi-organ proteomic landscape of COVID-19 autopsies. Cell. 2021 Feb 4;184(3):775-791.e14. doi: 10.1016/j.cell.2021.01.004. Epub 2021 Jan 9. PMID: 33503446; PMCID: PMC7794601.
[9]Zhu Y, Weiss T, Zhang Q, et al. High-throughput proteomic analysis of FFPE tissue samples facilitates tumor stratification. Mol Oncol. 2019 Nov;13(11):2305-2328. doi: 10.1002/1878-0261.12570. Epub 2019 Sep 18. PMID: 31495056; PMCID: PMC6822243.
[10]Ziegler CGK, Miao VN, Owings AH, et al. Impaired local intrinsic immunity to SARS-CoV-2 infection in severe COVID-19. Cell. 2021 Sep 2;184(18):4713-4733.e22. doi: 10.1016/j.cell.2021.07.023. Epub 2021 Jul 23. PMID: 34352228; PMCID: PMC8299217.
[11]Mathew D, Giles JR, Baxter AE, et al. Deep immune profiling of COVID-19 patients reveals distinct immunotypes with therapeutic implications. Science. 2020 Sep 4;369(6508):eabc8511. doi: 10.1126/science.abc8511. Epub 2020 Jul 15. PMID: 32669297; PMCID: PMC7402624.
[12]Sadarangani, M., Marchant, A. & Kollmann, T.R. Immunological mechanisms of vaccine-induced protection against COVID-19 in humans. Nat Rev Immunol 21, 475-484 (2021).
[13]Kuhlmann C, Mayer CK, Claassen M, et al. Breakthrough infections with SARS-CoV-2 omicron despite mRNA vaccine booster dose. Lancet. 2022 Feb 12;399(10325):625-626. doi: 10.1016/S0140-6736(22)00090-3. Epub 2022 Jan 18. Erratum in: Lancet. 2022 Feb 12;399(10325):628. PMID: 35063123; PMCID: PMC8765759.
[14]Kanji JN, Zelyas N, MacDonald C, et al. False negative rate of COVID-19 PCR testing: a discordant testing analysis. Virol J. 2021 Jan 9;18(1):13. doi: 10.1186/s12985-021-01489-0. PMID: 33422083; PMCID: PMC7794619.
[15]Shao W, Guo T, Toussaint NC, et al. Comparative analysis of mRNA and protein degradation in prostate tissues indicates high stability of proteins. Nat Commun. 2019 Jun 7;10(1):2524. doi: 10.1038/s41467-019-10513-5. PMID: 31175306; PMCID: PMC6555818.
[16]Xiao Q, Zhang F, Xu L, et al. High-throughput proteomics and AI for cancer biomarker discovery. Adv Drug Deliv Rev. 2021 Sep;176:113844. doi: 10.1016/j.addr.2021.113844. Epub 2021 Jun 26. PMID: 34182017.



