摘要:研究創(chuàng)新性地開展雙靶點mTORC1/2抑制劑onatasertib聯(lián)合PD-1抗體toripalimab的I/II期臨床試驗(TORCH-2)。
研究背景與科學(xué)問題
免疫檢查點抑制劑(CPI)雖革新了腫瘤治療格局,但PD-1/PD-L1抗體單藥治療僅能使部分患者獲益。在宮頸癌領(lǐng)域,即使PD-L1陽性患者接受pembrolizumab治療的客觀緩解率(ORR)不足20%,而PD-L1陰性患者幾乎無響應(yīng)。與此同時,PI3K-AKT-mTOR通路的異常激活在多種腫瘤中被證實可促進免疫逃逸,臨床前研究顯示mTOR抑制劑能通過調(diào)節(jié)腫瘤微環(huán)境(TME)增強PD-1抗體療效,但缺乏臨床證據(jù)支持。
為解決這一轉(zhuǎn)化醫(yī)學(xué)難題,由四川大學(xué)華西醫(yī)院領(lǐng)銜的研究團隊開展了全球首個mTORC1/2雙靶點抑制劑onatasertib(CC-223)聯(lián)合PD-1抗體toripalimab的I/II期臨床試驗(TORCH-2/NCT04337463),成果發(fā)表于《Signal Transduction and Targeted Therapy》。
 圖1 關(guān)于雙重TORC1/2抑制劑onatasertib聯(lián)合PD-1抗體特瑞普利單抗治療晚期實體腫瘤的多中心1/2期研究
圖1 關(guān)于雙重TORC1/2抑制劑onatasertib聯(lián)合PD-1抗體特瑞普利單抗治療晚期實體腫瘤的多中心1/2期研究關(guān)鍵技術(shù)方法
采用多中心、開放標簽的"3+3"劑量遞增聯(lián)合擴展設(shè)計,納入46例晚期實體瘤患者(45.7%為宮頸癌)。給藥方案為onatasertib(15/20/30 mg QD)口服聯(lián)合toripalimab(240 mg Q3W)靜脈注射,主要評估安全性(CTCAE v5.0)、藥代動力學(xué)(PK)和療效(RECIST 1.1)。通過免疫組化檢測PD-L1表達(TPS≥1%為陽性),采用Kaplan-Meier法分析生存數(shù)據(jù)。
研究結(jié)果
安全性結(jié)果
未觀察到劑量限制性毒性(DLT),最常見3-4級治療相關(guān)不良事件(TEAE)為淋巴細胞減少(23.9%)和皮疹(19.6%)。30 mg組因毒性導(dǎo)致的劑量調(diào)整更頻繁,15 mg組平均治療持續(xù)時間最長(43.6周)。
藥代動力學(xué)特征
10例患者的PK分析顯示,toripalimab聯(lián)合給藥未顯著改變onatasertib的血漿濃度-時間曲線,提示無臨床意義的藥物相互作用。
療效數(shù)據(jù)
全人群ORR達26.1%,疾病控制率(DCR)73.9%,中位PFS 4.3個月。宮頸癌亞組表現(xiàn)突出:
無論PD-L1狀態(tài),ORR 52.4%(PD-L1陰性41.7% vs 陽性66.7%)
DCR 90.5%,中位PFS 5.8個月
15 mg劑量組療效最優(yōu):ORR 60%,中位PFS 7.8個月
PD-L1表達相關(guān)性
PD-L1陽性與陰性患者的中位PFS無顯著差異(5.5 vs 4.3個月),突破現(xiàn)有免疫治療依賴PD-L1篩選的局限。
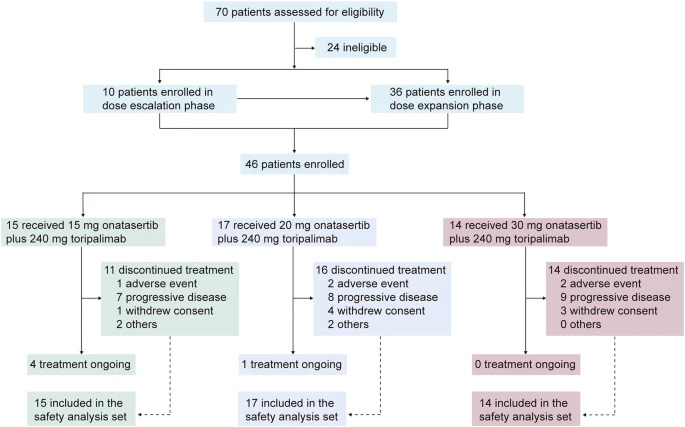
圖2 優(yōu)化用于預(yù)測泛癌種化療耐藥性的生物標志物
結(jié)論與意義
該研究首次臨床驗證mTORC1/2抑制劑聯(lián)合PD-1抗體的協(xié)同效應(yīng),確立15 mg onatasertib QD聯(lián)合240 mg toripalimab Q3W為推薦II期劑量(RP2D)。其重要意義在于:
為PD-L1陰性宮頸癌患者提供新選擇,ORR較歷史對照提升3倍
通過雙重阻斷mTORC1/2克服單靶點抑制劑的AKT反饋激活
證實PI3K-AKT-mTOR通路調(diào)控可重塑腫瘤免疫微環(huán)境
安全性特征可控,皮疹等不良反應(yīng)與既往單藥研究一致
未來需在更大樣本中驗證該方案對宮頸癌及其他PI3K-AKT-mTOR通路異常腫瘤的療效,并探索TILs浸潤等預(yù)測性生物標志物。該研究為免疫聯(lián)合靶向治療提供了新范式,尤其對解決免疫治療耐藥問題具有重要臨床價值。
參考資料
[1] Multicenter phase 1/2 study of onatasertib, a dual TORC1/2 inhibitor, combined with the PD-1 antibody toripalimab in advanced solid tumors
摘要:研究創(chuàng)新性地開展雙靶點mTORC1/2抑制劑onatasertib聯(lián)合PD-1抗體toripalimab的I/II期臨床試驗(TORCH-2)。
研究背景與科學(xué)問題
免疫檢查點抑制劑(CPI)雖革新了腫瘤治療格局,但PD-1/PD-L1抗體單藥治療僅能使部分患者獲益。在宮頸癌領(lǐng)域,即使PD-L1陽性患者接受pembrolizumab治療的客觀緩解率(ORR)不足20%,而PD-L1陰性患者幾乎無響應(yīng)。與此同時,PI3K-AKT-mTOR通路的異常激活在多種腫瘤中被證實可促進免疫逃逸,臨床前研究顯示mTOR抑制劑能通過調(diào)節(jié)腫瘤微環(huán)境(TME)增強PD-1抗體療效,但缺乏臨床證據(jù)支持。
為解決這一轉(zhuǎn)化醫(yī)學(xué)難題,由四川大學(xué)華西醫(yī)院領(lǐng)銜的研究團隊開展了全球首個mTORC1/2雙靶點抑制劑onatasertib(CC-223)聯(lián)合PD-1抗體toripalimab的I/II期臨床試驗(TORCH-2/NCT04337463),成果發(fā)表于《Signal Transduction and Targeted Therapy》。
 圖1 關(guān)于雙重TORC1/2抑制劑onatasertib聯(lián)合PD-1抗體特瑞普利單抗治療晚期實體腫瘤的多中心1/2期研究
圖1 關(guān)于雙重TORC1/2抑制劑onatasertib聯(lián)合PD-1抗體特瑞普利單抗治療晚期實體腫瘤的多中心1/2期研究關(guān)鍵技術(shù)方法
采用多中心、開放標簽的"3+3"劑量遞增聯(lián)合擴展設(shè)計,納入46例晚期實體瘤患者(45.7%為宮頸癌)。給藥方案為onatasertib(15/20/30 mg QD)口服聯(lián)合toripalimab(240 mg Q3W)靜脈注射,主要評估安全性(CTCAE v5.0)、藥代動力學(xué)(PK)和療效(RECIST 1.1)。通過免疫組化檢測PD-L1表達(TPS≥1%為陽性),采用Kaplan-Meier法分析生存數(shù)據(jù)。
研究結(jié)果
安全性結(jié)果
未觀察到劑量限制性毒性(DLT),最常見3-4級治療相關(guān)不良事件(TEAE)為淋巴細胞減少(23.9%)和皮疹(19.6%)。30 mg組因毒性導(dǎo)致的劑量調(diào)整更頻繁,15 mg組平均治療持續(xù)時間最長(43.6周)。
藥代動力學(xué)特征
10例患者的PK分析顯示,toripalimab聯(lián)合給藥未顯著改變onatasertib的血漿濃度-時間曲線,提示無臨床意義的藥物相互作用。
療效數(shù)據(jù)
全人群ORR達26.1%,疾病控制率(DCR)73.9%,中位PFS 4.3個月。宮頸癌亞組表現(xiàn)突出:
無論PD-L1狀態(tài),ORR 52.4%(PD-L1陰性41.7% vs 陽性66.7%)
DCR 90.5%,中位PFS 5.8個月
15 mg劑量組療效最優(yōu):ORR 60%,中位PFS 7.8個月
PD-L1表達相關(guān)性
PD-L1陽性與陰性患者的中位PFS無顯著差異(5.5 vs 4.3個月),突破現(xiàn)有免疫治療依賴PD-L1篩選的局限。

圖2 優(yōu)化用于預(yù)測泛癌種化療耐藥性的生物標志物
結(jié)論與意義
該研究首次臨床驗證mTORC1/2抑制劑聯(lián)合PD-1抗體的協(xié)同效應(yīng),確立15 mg onatasertib QD聯(lián)合240 mg toripalimab Q3W為推薦II期劑量(RP2D)。其重要意義在于:
為PD-L1陰性宮頸癌患者提供新選擇,ORR較歷史對照提升3倍
通過雙重阻斷mTORC1/2克服單靶點抑制劑的AKT反饋激活
證實PI3K-AKT-mTOR通路調(diào)控可重塑腫瘤免疫微環(huán)境
安全性特征可控,皮疹等不良反應(yīng)與既往單藥研究一致
未來需在更大樣本中驗證該方案對宮頸癌及其他PI3K-AKT-mTOR通路異常腫瘤的療效,并探索TILs浸潤等預(yù)測性生物標志物。該研究為免疫聯(lián)合靶向治療提供了新范式,尤其對解決免疫治療耐藥問題具有重要臨床價值。
參考資料
[1] Multicenter phase 1/2 study of onatasertib, a dual TORC1/2 inhibitor, combined with the PD-1 antibody toripalimab in advanced solid tumors



