摘要:研究人員的一項(xiàng)新研究表明,轉(zhuǎn)移RNA (tRNA)在調(diào)節(jié)這些指令在細(xì)胞中持續(xù)的時(shí)間方面也起著關(guān)鍵作用。
德克薩斯大學(xué)西南醫(yī)學(xué)中心研究人員的一項(xiàng)新研究表明,轉(zhuǎn)移RNA (tRNA)是一種以讀取構(gòu)建蛋白指令而聞名的遺傳分子,在調(diào)節(jié)這些指令在細(xì)胞中持續(xù)的時(shí)間方面也起著關(guān)鍵作用。發(fā)表在《Science》雜志上的這一發(fā)現(xiàn),擴(kuò)大了對信使RNA (mRNA)降解時(shí)間的理解,信使RNA是控制基因活動的重要機(jī)制,最終可能有可能導(dǎo)致肥胖、癌癥和其他健康狀況的新療法。
“我們的工作揭示了tRNA在控制mRNA穩(wěn)定性和將mRNA序列與其衰減速率聯(lián)系起來方面的基本作用,”德克薩斯大學(xué)西南分校分子生物學(xué)教授、霍華德休斯醫(yī)學(xué)研究所研究員Joshua T. Mendell醫(yī)學(xué)博士說。Mendell博士與生物物理學(xué)副教授Jan P. Erzberger博士和分子生物學(xué)助理講師朱曉強(qiáng)博士共同領(lǐng)導(dǎo)了這項(xiàng)研究。
 圖1 特異性tRNA通過募集CCR4-NOT復(fù)合物翻譯核糖體來促進(jìn)mRNA衰變
圖1 特異性tRNA通過募集CCR4-NOT復(fù)合物翻譯核糖體來促進(jìn)mRNA衰變Mendell博士解釋說,每種mRNA轉(zhuǎn)錄物在細(xì)胞中持續(xù)多久,對于決定每種蛋白質(zhì)的合成量至關(guān)重要,而蛋白質(zhì)的合成量反過來又影響細(xì)胞的功能。例如,mRNA疫苗——就像全世界數(shù)十億人為預(yù)防導(dǎo)致COVID-19的病毒而接種的疫苗一樣——當(dāng)mRNA長時(shí)間存在時(shí),效果最好,導(dǎo)致細(xì)胞繼續(xù)大量產(chǎn)生蛋白質(zhì),為免疫系統(tǒng)的攻擊做好準(zhǔn)備。相反,產(chǎn)生編輯DNA蛋白質(zhì)的mRNA,如可以糾正遺傳錯(cuò)誤的CRISPR蛋白,需要在完成任務(wù)后立即移除,這樣健康的DNA就不會受到錯(cuò)誤的傷害。
盡管已知一種名為CCR4-NOT的分子復(fù)合物在降解mRNA中起著核心作用,但CCR4-NOT如何在人類細(xì)胞中被招募到特定的mRNA中尚不清楚。
為了回答這個(gè)問題,Mendell實(shí)驗(yàn)室和Erzberger實(shí)驗(yàn)室——這兩個(gè)實(shí)驗(yàn)室使用互補(bǔ)的方法研究RNA生物學(xué)的不同方面——共同努力。研究小組一起開始鑒定人類細(xì)胞中與CCR4-NOT復(fù)合物最密切相關(guān)的mRNA。
Erzberger博士說:“我們發(fā)現(xiàn),這些mRNA在指令或密碼子方面高度富集,這些指令或密碼子告訴細(xì)胞將氨基酸精氨酸添加到編碼的蛋白質(zhì)中。”
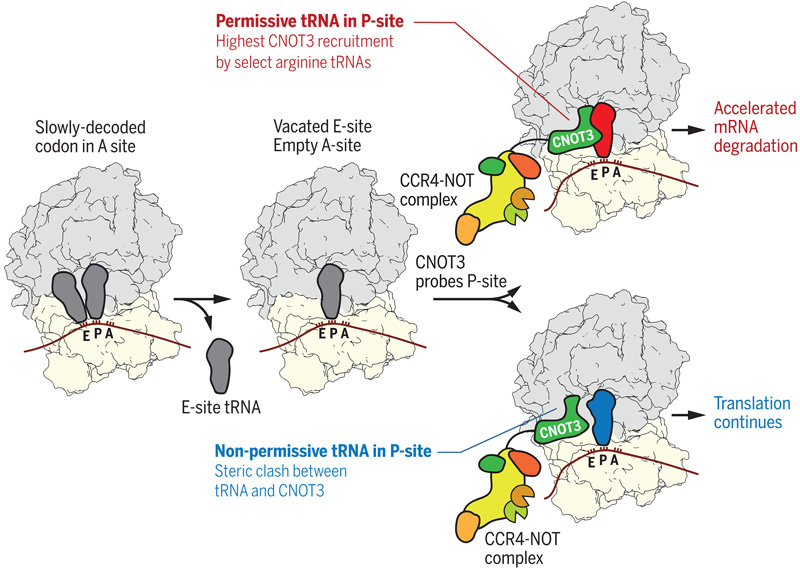
圖2 P位點(diǎn)tRNA控制CCR4-NOT復(fù)合物向翻譯核糖體的募集
曾在Erzberger實(shí)驗(yàn)室工作的高級研發(fā)科學(xué)家Victor Emmanuel Cruz博士在UTSW的冷凍電鏡設(shè)備中進(jìn)行了結(jié)構(gòu)研究,證實(shí)了當(dāng)合成蛋白質(zhì)(稱為核糖體)的細(xì)胞機(jī)器遇到三種特殊精氨酸密碼子之一時(shí),識別這些密碼子的tRNA招募CCR4-NOT復(fù)合物開始mRNA降解過程。當(dāng)研究人員對mRNA進(jìn)行突變,使其不再編碼精氨酸,或者對tRNA進(jìn)行突變,使其不能招募CCR4-NOT時(shí),通常會被降解的mRNA反而在細(xì)胞中持續(xù)存在,并產(chǎn)生了更多的蛋白質(zhì)。
研究人員發(fā)現(xiàn),產(chǎn)生線粒體(細(xì)胞中產(chǎn)生能量的細(xì)胞器)部分蛋白質(zhì)的mRNA最有可能具有誘導(dǎo)衰變的精氨酸密碼子。因此,識別精氨酸密碼子的tRNA損害CCR4-NOT的募集會導(dǎo)致細(xì)胞線粒體的豐度和活性增加。
Mendell博士說,由于線粒體mRNA受到這種新發(fā)現(xiàn)的降解信號的影響最為嚴(yán)重,研究人員最終可能能夠利用這種機(jī)制來治療某些遺傳性線粒體疾病,以及線粒體在其中發(fā)揮關(guān)鍵作用的其他疾病,如肥胖和癌癥。
參考資料
[1] Specific tRNAs promote mRNA decay by recruiting the CCR4-NOT complex to translating ribosomes
摘要:研究人員的一項(xiàng)新研究表明,轉(zhuǎn)移RNA (tRNA)在調(diào)節(jié)這些指令在細(xì)胞中持續(xù)的時(shí)間方面也起著關(guān)鍵作用。
德克薩斯大學(xué)西南醫(yī)學(xué)中心研究人員的一項(xiàng)新研究表明,轉(zhuǎn)移RNA (tRNA)是一種以讀取構(gòu)建蛋白指令而聞名的遺傳分子,在調(diào)節(jié)這些指令在細(xì)胞中持續(xù)的時(shí)間方面也起著關(guān)鍵作用。發(fā)表在《Science》雜志上的這一發(fā)現(xiàn),擴(kuò)大了對信使RNA (mRNA)降解時(shí)間的理解,信使RNA是控制基因活動的重要機(jī)制,最終可能有可能導(dǎo)致肥胖、癌癥和其他健康狀況的新療法。
“我們的工作揭示了tRNA在控制mRNA穩(wěn)定性和將mRNA序列與其衰減速率聯(lián)系起來方面的基本作用,”德克薩斯大學(xué)西南分校分子生物學(xué)教授、霍華德休斯醫(yī)學(xué)研究所研究員Joshua T. Mendell醫(yī)學(xué)博士說。Mendell博士與生物物理學(xué)副教授Jan P. Erzberger博士和分子生物學(xué)助理講師朱曉強(qiáng)博士共同領(lǐng)導(dǎo)了這項(xiàng)研究。
 圖1 特異性tRNA通過募集CCR4-NOT復(fù)合物翻譯核糖體來促進(jìn)mRNA衰變
圖1 特異性tRNA通過募集CCR4-NOT復(fù)合物翻譯核糖體來促進(jìn)mRNA衰變Mendell博士解釋說,每種mRNA轉(zhuǎn)錄物在細(xì)胞中持續(xù)多久,對于決定每種蛋白質(zhì)的合成量至關(guān)重要,而蛋白質(zhì)的合成量反過來又影響細(xì)胞的功能。例如,mRNA疫苗——就像全世界數(shù)十億人為預(yù)防導(dǎo)致COVID-19的病毒而接種的疫苗一樣——當(dāng)mRNA長時(shí)間存在時(shí),效果最好,導(dǎo)致細(xì)胞繼續(xù)大量產(chǎn)生蛋白質(zhì),為免疫系統(tǒng)的攻擊做好準(zhǔn)備。相反,產(chǎn)生編輯DNA蛋白質(zhì)的mRNA,如可以糾正遺傳錯(cuò)誤的CRISPR蛋白,需要在完成任務(wù)后立即移除,這樣健康的DNA就不會受到錯(cuò)誤的傷害。
盡管已知一種名為CCR4-NOT的分子復(fù)合物在降解mRNA中起著核心作用,但CCR4-NOT如何在人類細(xì)胞中被招募到特定的mRNA中尚不清楚。
為了回答這個(gè)問題,Mendell實(shí)驗(yàn)室和Erzberger實(shí)驗(yàn)室——這兩個(gè)實(shí)驗(yàn)室使用互補(bǔ)的方法研究RNA生物學(xué)的不同方面——共同努力。研究小組一起開始鑒定人類細(xì)胞中與CCR4-NOT復(fù)合物最密切相關(guān)的mRNA。
Erzberger博士說:“我們發(fā)現(xiàn),這些mRNA在指令或密碼子方面高度富集,這些指令或密碼子告訴細(xì)胞將氨基酸精氨酸添加到編碼的蛋白質(zhì)中。”

圖2 P位點(diǎn)tRNA控制CCR4-NOT復(fù)合物向翻譯核糖體的募集
曾在Erzberger實(shí)驗(yàn)室工作的高級研發(fā)科學(xué)家Victor Emmanuel Cruz博士在UTSW的冷凍電鏡設(shè)備中進(jìn)行了結(jié)構(gòu)研究,證實(shí)了當(dāng)合成蛋白質(zhì)(稱為核糖體)的細(xì)胞機(jī)器遇到三種特殊精氨酸密碼子之一時(shí),識別這些密碼子的tRNA招募CCR4-NOT復(fù)合物開始mRNA降解過程。當(dāng)研究人員對mRNA進(jìn)行突變,使其不再編碼精氨酸,或者對tRNA進(jìn)行突變,使其不能招募CCR4-NOT時(shí),通常會被降解的mRNA反而在細(xì)胞中持續(xù)存在,并產(chǎn)生了更多的蛋白質(zhì)。
研究人員發(fā)現(xiàn),產(chǎn)生線粒體(細(xì)胞中產(chǎn)生能量的細(xì)胞器)部分蛋白質(zhì)的mRNA最有可能具有誘導(dǎo)衰變的精氨酸密碼子。因此,識別精氨酸密碼子的tRNA損害CCR4-NOT的募集會導(dǎo)致細(xì)胞線粒體的豐度和活性增加。
Mendell博士說,由于線粒體mRNA受到這種新發(fā)現(xiàn)的降解信號的影響最為嚴(yán)重,研究人員最終可能能夠利用這種機(jī)制來治療某些遺傳性線粒體疾病,以及線粒體在其中發(fā)揮關(guān)鍵作用的其他疾病,如肥胖和癌癥。
參考資料
[1] Specific tRNAs promote mRNA decay by recruiting the CCR4-NOT complex to translating ribosomes



