摘要:腫瘤細(xì)胞抑制核糖體功能逃避免疫應(yīng)答的發(fā)現(xiàn)。
來自荷蘭癌癥研究所的William James Faller領(lǐng)導(dǎo)的一個研究小組發(fā)現(xiàn)了癌細(xì)胞用來實現(xiàn)免疫逃避的一種新機制。
他們的研究發(fā)表在10月22日的權(quán)威雜志《Cell》上,揭示了癌細(xì)胞如何干擾核糖體功能,影響免疫反應(yīng)并導(dǎo)致免疫逃逸。

圖1 P-柄核糖體是細(xì)胞因子介導(dǎo)過程的主要調(diào)節(jié)因子
主要發(fā)現(xiàn):核糖體和T細(xì)胞反應(yīng)
該研究強調(diào)了一種稱為P-stalk核糖體(PSR)的獨特核糖體亞基的作用。當(dāng)免疫細(xì)胞如T細(xì)胞分泌干擾素-γ (IFN-γ)和腫瘤壞死因子-α (TNF-α)等細(xì)胞因子時,這些細(xì)胞因子誘導(dǎo)PSRs的形成。PSRs通過翻譯關(guān)鍵的免疫相關(guān)分子來增強抗原加工和遞呈,使T細(xì)胞更容易識別和殺死癌細(xì)胞。
然而,研究人員發(fā)現(xiàn)PSRs的缺失會損害CD8+ T細(xì)胞識別和破壞癌細(xì)胞的能力。此外,某些免疫抑制因子如TGF-β阻礙PSR的形成,幫助癌細(xì)胞避免免疫檢測。
分子拔河比賽
這項研究提供了一個新的視角:核糖體,通常作為“蛋白質(zhì)工廠”的功能,在免疫反應(yīng)中起著關(guān)鍵作用。在接收到來自T細(xì)胞的信號后,核糖體應(yīng)該增加分子的產(chǎn)生,使癌細(xì)胞受到免疫攻擊。然而,癌細(xì)胞已經(jīng)發(fā)展出阻止這一過程的機制,破壞核糖體功能并隱藏自己免受免疫監(jiān)視。
這一發(fā)現(xiàn)通過關(guān)注核糖體在免疫信號存在下是如何調(diào)節(jié)的,為癌癥免疫治療提供了有希望的新靶點。
為什么核糖體在癌癥免疫中很重要
Faller團隊對核糖體的興趣源于先前的研究,將核糖體蛋白與T細(xì)胞存活、樹突狀細(xì)胞激活和免疫系統(tǒng)檢測癌細(xì)胞的能力聯(lián)系起來。具體來說,核糖體蛋白可以影響MHC I類肽的產(chǎn)生,這對免疫監(jiān)測至關(guān)重要。
在目前的研究中,研究人員用IFN-γ和TNF-α治療黑色素瘤細(xì)胞,并分析核糖體蛋白組成的變化。他們觀察到P柄核糖體的關(guān)鍵成分P1和P2蛋白的水平隨著這些細(xì)胞因子的增加而增加。值得注意的是,并非所有核糖體蛋白都受到影響,這表明這種變化是高度特異性的。
PSR的形成和免疫抑制
進(jìn)一步分析證實,PSR水平隨著暴露于各種免疫激活因子(如IFN-α、IFN-β和IL-1β)而升高,但在免疫抑制因子TGF-β的影響下下降。這一現(xiàn)象在多個癌細(xì)胞系中被觀察到,表明該機制是普遍存在的。
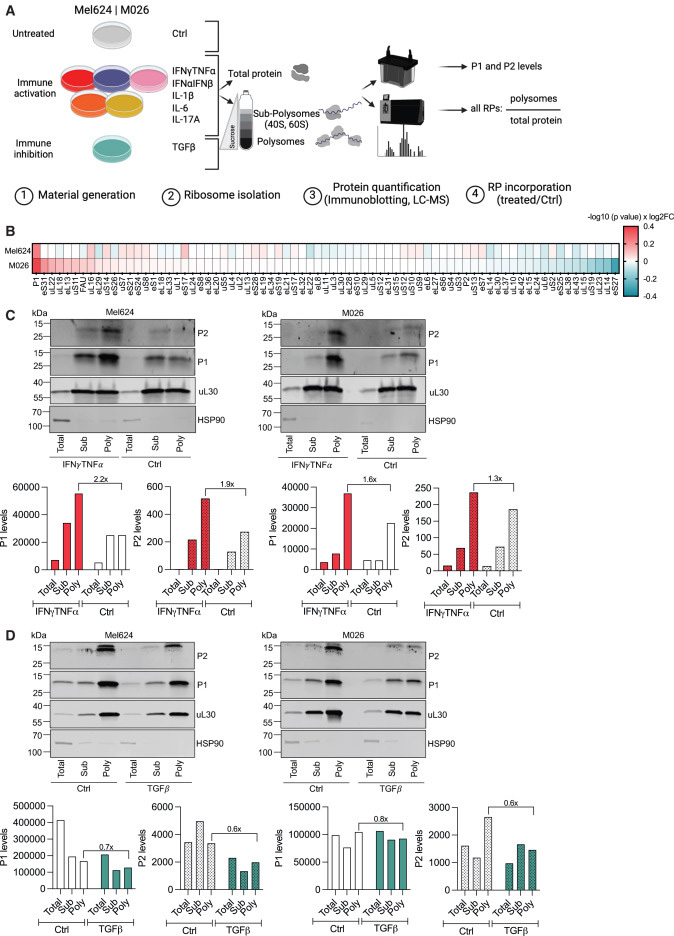
圖2 P-柄定義了一種細(xì)胞因子反應(yīng)性核糖體亞群
為了了解功能上的影響,研究人員敲除了P1基因來制造PSR缺陷細(xì)胞。這些修飾過的細(xì)胞表面HLA-A/B/C分子水平較低,降低了它們對免疫細(xì)胞的可見性。與T細(xì)胞共培養(yǎng)實驗表明,這些PSR缺陷的癌細(xì)胞對T細(xì)胞介導(dǎo)的殺傷不太敏感。
臨床見解和更廣泛的影響
研究人員分析了來自TCGA(癌癥基因組圖譜)的數(shù)據(jù),發(fā)現(xiàn)高P1/P2蛋白水平與黑色素瘤細(xì)胞中IFN-γ和CD8+ T細(xì)胞活性增加呈正相關(guān)。在分析的36種癌癥類型中,有24種觀察到類似的趨勢,這表明PSR調(diào)節(jié)是癌癥免疫反應(yīng)的共同特征。
該研究還表明,PSR缺陷會損害巨噬細(xì)胞抗原的加工和遞呈,進(jìn)一步損害免疫應(yīng)答。
此外,F(xiàn)aller的團隊探索了P1和P2蛋白的磷酸化如何調(diào)節(jié)它們與核糖體的附著。IFN-γ和TNF-α誘導(dǎo)的去磷酸化促進(jìn)PSR的形成,增強免疫應(yīng)答。
結(jié)論:腫瘤免疫治療的新靶點
該研究為P-柄核糖體在調(diào)節(jié)免疫反應(yīng)中的作用提供了開創(chuàng)性的見解。PSRs選擇性地翻譯與免疫信號相關(guān)的mRNA,其形成受促炎性和抗炎性細(xì)胞因子的控制。然而,PSRs優(yōu)先處理某些mRNA的確切機制尚不清楚,需要進(jìn)一步研究。
這一發(fā)現(xiàn)提示PSR功能障礙可能是癌細(xì)胞逃避免疫檢測的一種策略,為加強癌癥免疫治療提供了新的治療靶點。未來的研究可以探索調(diào)節(jié)PSRs的方法,以提高免疫系統(tǒng)對各種癌癥類型腫瘤的性能。
參考資料
[1] P-stalk ribosomes act as master regulators of cytokine-mediated processes
摘要:腫瘤細(xì)胞抑制核糖體功能逃避免疫應(yīng)答的發(fā)現(xiàn)。
來自荷蘭癌癥研究所的William James Faller領(lǐng)導(dǎo)的一個研究小組發(fā)現(xiàn)了癌細(xì)胞用來實現(xiàn)免疫逃避的一種新機制。
他們的研究發(fā)表在10月22日的權(quán)威雜志《Cell》上,揭示了癌細(xì)胞如何干擾核糖體功能,影響免疫反應(yīng)并導(dǎo)致免疫逃逸。

圖1 P-柄核糖體是細(xì)胞因子介導(dǎo)過程的主要調(diào)節(jié)因子
主要發(fā)現(xiàn):核糖體和T細(xì)胞反應(yīng)
該研究強調(diào)了一種稱為P-stalk核糖體(PSR)的獨特核糖體亞基的作用。當(dāng)免疫細(xì)胞如T細(xì)胞分泌干擾素-γ (IFN-γ)和腫瘤壞死因子-α (TNF-α)等細(xì)胞因子時,這些細(xì)胞因子誘導(dǎo)PSRs的形成。PSRs通過翻譯關(guān)鍵的免疫相關(guān)分子來增強抗原加工和遞呈,使T細(xì)胞更容易識別和殺死癌細(xì)胞。
然而,研究人員發(fā)現(xiàn)PSRs的缺失會損害CD8+ T細(xì)胞識別和破壞癌細(xì)胞的能力。此外,某些免疫抑制因子如TGF-β阻礙PSR的形成,幫助癌細(xì)胞避免免疫檢測。
分子拔河比賽
這項研究提供了一個新的視角:核糖體,通常作為“蛋白質(zhì)工廠”的功能,在免疫反應(yīng)中起著關(guān)鍵作用。在接收到來自T細(xì)胞的信號后,核糖體應(yīng)該增加分子的產(chǎn)生,使癌細(xì)胞受到免疫攻擊。然而,癌細(xì)胞已經(jīng)發(fā)展出阻止這一過程的機制,破壞核糖體功能并隱藏自己免受免疫監(jiān)視。
這一發(fā)現(xiàn)通過關(guān)注核糖體在免疫信號存在下是如何調(diào)節(jié)的,為癌癥免疫治療提供了有希望的新靶點。
為什么核糖體在癌癥免疫中很重要
Faller團隊對核糖體的興趣源于先前的研究,將核糖體蛋白與T細(xì)胞存活、樹突狀細(xì)胞激活和免疫系統(tǒng)檢測癌細(xì)胞的能力聯(lián)系起來。具體來說,核糖體蛋白可以影響MHC I類肽的產(chǎn)生,這對免疫監(jiān)測至關(guān)重要。
在目前的研究中,研究人員用IFN-γ和TNF-α治療黑色素瘤細(xì)胞,并分析核糖體蛋白組成的變化。他們觀察到P柄核糖體的關(guān)鍵成分P1和P2蛋白的水平隨著這些細(xì)胞因子的增加而增加。值得注意的是,并非所有核糖體蛋白都受到影響,這表明這種變化是高度特異性的。
PSR的形成和免疫抑制
進(jìn)一步分析證實,PSR水平隨著暴露于各種免疫激活因子(如IFN-α、IFN-β和IL-1β)而升高,但在免疫抑制因子TGF-β的影響下下降。這一現(xiàn)象在多個癌細(xì)胞系中被觀察到,表明該機制是普遍存在的。

圖2 P-柄定義了一種細(xì)胞因子反應(yīng)性核糖體亞群
為了了解功能上的影響,研究人員敲除了P1基因來制造PSR缺陷細(xì)胞。這些修飾過的細(xì)胞表面HLA-A/B/C分子水平較低,降低了它們對免疫細(xì)胞的可見性。與T細(xì)胞共培養(yǎng)實驗表明,這些PSR缺陷的癌細(xì)胞對T細(xì)胞介導(dǎo)的殺傷不太敏感。
臨床見解和更廣泛的影響
研究人員分析了來自TCGA(癌癥基因組圖譜)的數(shù)據(jù),發(fā)現(xiàn)高P1/P2蛋白水平與黑色素瘤細(xì)胞中IFN-γ和CD8+ T細(xì)胞活性增加呈正相關(guān)。在分析的36種癌癥類型中,有24種觀察到類似的趨勢,這表明PSR調(diào)節(jié)是癌癥免疫反應(yīng)的共同特征。
該研究還表明,PSR缺陷會損害巨噬細(xì)胞抗原的加工和遞呈,進(jìn)一步損害免疫應(yīng)答。
此外,F(xiàn)aller的團隊探索了P1和P2蛋白的磷酸化如何調(diào)節(jié)它們與核糖體的附著。IFN-γ和TNF-α誘導(dǎo)的去磷酸化促進(jìn)PSR的形成,增強免疫應(yīng)答。
結(jié)論:腫瘤免疫治療的新靶點
該研究為P-柄核糖體在調(diào)節(jié)免疫反應(yīng)中的作用提供了開創(chuàng)性的見解。PSRs選擇性地翻譯與免疫信號相關(guān)的mRNA,其形成受促炎性和抗炎性細(xì)胞因子的控制。然而,PSRs優(yōu)先處理某些mRNA的確切機制尚不清楚,需要進(jìn)一步研究。
這一發(fā)現(xiàn)提示PSR功能障礙可能是癌細(xì)胞逃避免疫檢測的一種策略,為加強癌癥免疫治療提供了新的治療靶點。未來的研究可以探索調(diào)節(jié)PSRs的方法,以提高免疫系統(tǒng)對各種癌癥類型腫瘤的性能。
參考資料
[1] P-stalk ribosomes act as master regulators of cytokine-mediated processes



